クローディン研究の第一期集大成
これまでに紹介してきた通りのドラマティックな展開により、クローディンが発見されました。
我々にとって、この一年は実に、確かに、ドラマティックでした。 昨年の暮れぐらいから、
この時点でのクローディン研究の現状と考え方を何らかの形でまとめておきたいと考えるように
なってきました。 そうしたおり、まず、日本生化学会の機関誌の「生化学」からクローディン
に関する総説を依頼されました。 さらに、私達が最も大切にしているJournal of Cell Biology
からも最近の進歩をレビュ-することを頼まれました。 そこで、日本で生まれ日本で育って
きた我々の研究グループが、独自の考えで進めてきた研究の成果とその考えを日本に向けてと、
世界に向けてとほぼ同時に発信してみようと思い、2つの総説を書きました。
ここにその2つを転載します。
「生化学」2000年3月号 掲載
タイトジャンクションを構成する4回膜貫通型蛋白質
オクルディンとクローディンの発見:
Paracellular Pathwayの新しい生理学へ向けて
月田承一郎・古瀬幹夫
[抄録」タイトジャンクションは、上皮細胞シートや内皮細胞シートにおいて、細胞間をシールする重要な細胞間接着装置であるが、一方で、このジャンクションを横切って物質が細胞間の通路(paracellular
pathway)を運ばれることも知られている。 タイトジャンクションにおいて隣合う細胞膜をゼロの距離にまで近づけている接着分子の実体は長い間謎に包まれていたが、最近になってようやく、4回膜貫通型蛋白質であるオクルディンとクローディンが同定された。 この発見によって、タイトジャンクションの機能を分子生物学的手法を用いて解析することが可能となり、新しいparacellular
pathwayの生理学が生まれようとしている。
1.はじめに
多数の細胞が機械的に結びつけられている多細胞生物の形作りにおいて、細胞間および細胞基質間の接着の果たす役割は大きい。 多様な接着分子が、機械的な結合(接着)だけでなく、特異的な細胞認識や複雑な接着シグナルの伝達にもかかわっていることが、次々と明らかにされている。 しかし、これらとは全く別の観点から、細胞間の接着が多細胞生物にとって本質的に重要であることが古くから知られている。 それは、「細胞間を通った物質の移動(漏れ)の制御」という観点である。
多細胞生物は上皮細胞に囲まれることにより、まず、自己の内と外に区別される。 そして、体の中は、上皮細胞や内皮細胞のシートにより、さらにいくつもの部屋に分けられている。 脳、血管、腎臓の尿細管などはその代表的な部屋であるが、特殊なものでは甲状腺の濾胞、内耳の蝸牛管なども挙げられる。 部屋の中のイオン環境や蛋白質の種類・濃度などは、それぞれの機能に応じて大きく異なっており、この環境を動的に保っていることが、多細胞生物が生きていく上で必要不可欠である。 しかし、多細胞生物であるが故に、これらの部屋を仕切る壁は細胞を並べて作らざるを得ないが、いくらカドヘリンなどの強力な接着分子で細胞間を結合させても、水・イオン・蛋白質などは細胞間を自由に通ることができる。 そこで、多細胞生物が存在するためには、この細胞間を通った物質の移動(漏れ)を防ぐための特殊な接着機構が必要となる。 それが後述するタイトジャンクション(以下TJ)と呼ばれる接着装置で、ここでは隣り合う細胞の細胞膜の距離がゼロにまで近づいていて、細胞間を通った物質の移動を防いでいる。
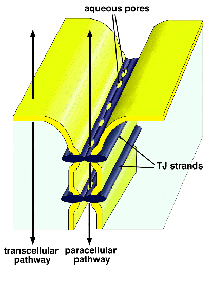
脊椎動物では、このTJを上皮細胞間や内皮細胞間に発達させることにより、これらの細胞シートが各部屋の環境を守るバリアーとして働くことを可能としている。 しかし、先にも述べたように、各部屋の内部の環境は静的に保たれているのではなく、部屋の外と物質の交換をしながら動的に保たれている。 この際、いろいろな物質が細胞シートを横切る必要があるが、それには図1に示すような2つのルートがある。 細胞そのもの、すなわち細胞膜そのものを横切って運ばれるルートはtranscellular
pathwayと呼ばれ、ここには多くのチャネル分子やポンプ、トランスポーターなどがかかわっている。
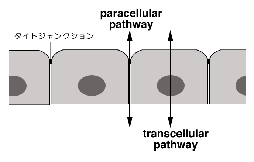 このpathwayはこれまでの生理学研究の中心的テーマであった。 一方、細胞間、すなわちTJを横切って運ばれるルートはparacellualr
pathwayと呼ばれる。 TJがバリアーのために存在するという、先の議論と一見矛盾するようであるが、実際にはTJのバリアー機能は、きわめてtightなものから、かなりleakyなものまで相当の幅があり、一般的にTJは選択的にイオンなどを通しうるバリアーであると言うことができる。 すなわちTJはparacellular
channelとでも言うべき“穴”を内包すると考えられるのである1)。 物質によっては主にparacellular pathwayを通って部屋の内外で交換されることも知られており、このpathwayもtranscellualr
pathwayと同様に重要であると考えられてきた。 しかし、TJの分子的基盤に関する我々の知識がきわめて未熟であったために、その解析は遅れていた2)。
このpathwayはこれまでの生理学研究の中心的テーマであった。 一方、細胞間、すなわちTJを横切って運ばれるルートはparacellualr
pathwayと呼ばれる。 TJがバリアーのために存在するという、先の議論と一見矛盾するようであるが、実際にはTJのバリアー機能は、きわめてtightなものから、かなりleakyなものまで相当の幅があり、一般的にTJは選択的にイオンなどを通しうるバリアーであると言うことができる。 すなわちTJはparacellular
channelとでも言うべき“穴”を内包すると考えられるのである1)。 物質によっては主にparacellular pathwayを通って部屋の内外で交換されることも知られており、このpathwayもtranscellualr
pathwayと同様に重要であると考えられてきた。 しかし、TJの分子的基盤に関する我々の知識がきわめて未熟であったために、その解析は遅れていた2)。
2. タイトジャンクションの構造
単層の上皮細胞では、隣り合う細胞膜(ラテラル膜)のもっともアピカルよりに細胞間接着装置複合体と呼ばれる領域があり、その部分で隣り合う細胞が強く接着している(図2A)。 この領域は3つに分かれ、アピカル側からタイトジャンクション(TJ)、アドヘレンスジャンクション(AJ)、デスモソーム(DS)と呼ばれる3)。 AJにはカドヘリンが接着分子として濃縮しており、よく発達した裏打ち構造を介してアクチンフィラメントが密に細胞膜に結合している。 DSでもやはりカドヘリン様の接着分子が機能しており、ここ
 では中間径フィラメントが結合している。 これら2つの接着装置では向かい合う細胞膜間の距離は15-20 nmに保たれている。 細胞間の強い機械的結合を担っており、その結合力を細胞骨格につなげることにより、組織全体としての機械的強度をも担っている。 これらに較べ、TJは特殊な接着装置である。 超薄切片像で見ると、ところどころで向かい合う細胞膜間の距離がゼロにまで近づいている3)(TJのキッシングポイントと呼ばれる)(図2B)。 また、凍結割断レプリカ法で観察すると、TJの部分では、膜内粒子が一列に並んだストランド(TJストランド)が編み目を構成している4)(図2C)。 このような観察から、TJの構造は図2Aのようなものであると想像されてきた。 すなわち、何らかの内在性膜蛋白質が細胞膜の中で線状に重合してTJストランドを形成し、向かい合う細胞膜中のTJストランドと側面で対合することによりキッシングポイントを形成するという構造である。 しかし、このTJストランドを構成する内在性膜蛋白質の実体は長い間謎に包まれており、TJストランドが特殊な脂質の逆ミセルから出来ているという脂質説も有力視されて続けてきた5)。
では中間径フィラメントが結合している。 これら2つの接着装置では向かい合う細胞膜間の距離は15-20 nmに保たれている。 細胞間の強い機械的結合を担っており、その結合力を細胞骨格につなげることにより、組織全体としての機械的強度をも担っている。 これらに較べ、TJは特殊な接着装置である。 超薄切片像で見ると、ところどころで向かい合う細胞膜間の距離がゼロにまで近づいている3)(TJのキッシングポイントと呼ばれる)(図2B)。 また、凍結割断レプリカ法で観察すると、TJの部分では、膜内粒子が一列に並んだストランド(TJストランド)が編み目を構成している4)(図2C)。 このような観察から、TJの構造は図2Aのようなものであると想像されてきた。 すなわち、何らかの内在性膜蛋白質が細胞膜の中で線状に重合してTJストランドを形成し、向かい合う細胞膜中のTJストランドと側面で対合することによりキッシングポイントを形成するという構造である。 しかし、このTJストランドを構成する内在性膜蛋白質の実体は長い間謎に包まれており、TJストランドが特殊な脂質の逆ミセルから出来ているという脂質説も有力視されて続けてきた5)。
3.オクルディンの同定と機能解析
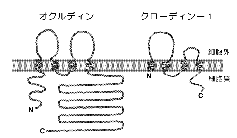
我々は、もともと、カドヘリンが機能するAJの分子構築を明らかにするために、AJが濃縮した分画を肝臓から単離する方法を開発していた6)。 そして、詳細は省略するが、ZO-1と呼ばれる細胞膜裏打ち蛋白質のcDNAクローニングの過程で、この分画にTJも極度に濃縮していることに気づいた7)。 もし、TJストランドが内在性膜蛋白質によって構成されているのであれば、そのような蛋白質もこの分画に濃縮している筈である。 そこでこの単離分画を抗原にしてモノクローナル抗体を得ることにより、TJストランドを構成する膜蛋白質の同定を試みることにした。 実際には高い抗原性を得るために、ヒヨコの肝臓から分画を得て、それをラットに免疫することにより多数のモノクローナル抗体を得た。 その中からTJの膜蛋白質を認識する可能性のあるモノクローナル抗体を絞り込んだところ、分子量65kDaぐらいの幅広いバンドを認識するものが3種類とれた。 これらの抗体は電子顕微鏡レベルでTJストランドそのものを認識した。 また、その抗原が内在性膜蛋白質であることも生化学的に確認できた。 そこでこの抗原をオクルディン(occludin:ラテン語のocclude、閉じるの意、から)と名付け、そのcDNAを単離したところ、新規の4回膜貫通型蛋白質であることが明らかになった8)。 図3に示すように、オクルディンはそのN末端側半分にそれぞれ約40アミノ酸からなる2つの細胞外ループを持つが、特に第一ループの約70%のアミノ酸がチロシンかグリシンという奇妙な構造をしていた。 このようにして、TJストランドを構成する膜蛋白質として、ニワトリのオクルディンが初めて同定されたのは、1993年の暮れのことで、TJの構造と機能の理解が一気に進むかと思われた2)。 しかし、実際には、オクルディンのアミノ酸配列が種間で大きく変動していたために、マウスやヒトのオクルディンの同定は難航した。 徐々に充実してきた遺伝子のデータベースの中から、我々が幸運にもヒトのオクルディンの一部の配列を見つけ、ようやくほ乳類のオクルディンの同定に成功するまでに約2年の時間が必要であった9)。
一方で、ニワトリではあるが、TJの内在性膜蛋白質が見つかったということで、多くの研究室でオクルディンの機能解析が始まった。 その結果、オクルディンがTJストランドの形成を通して、TJの機能を直接担っているということを主張する論文が次々と発表されるようになった10)。 しかし、我々は、本当にオクルディンだけでTJストランドが形成されているのかどうかについて、徐々に疑問を持つようになってきた。 このような疑問に直接答える一つの方法は、オクルディンの遺伝子をノックアウトすることである。 そこで、マウスのオクルディン遺伝子の単離に成功した後に、相同組み換えを利用してES(embryonic
stem)細胞においてオクルディンの遺伝子をダブルノックアウトした。 その細胞を試験館内で上皮細胞に分化させたところ、予想外なことに、オクルディンを発現しないこのような上皮細胞でも立派なTJストランドのネットワークが形成された11)。 この事実は、オクルディンがなくてもTJストランドが形成されるということを意味していた。
4.クローディン-1、-2の同定
このように遺伝子を破壊してもフェノタイプに変化がない場合は、オクルディン遺伝子がファミリーを形成していて、他のメンバーが代わりをするためと考えるのが普通である。 しかし、オクルディンに関しては、データベース上も、RT-PCR等による検索上も、似たアミノ酸配列を持つ膜蛋白質は見つからなかった。 そこで、オクルディンと何らかの意味で相互作用する膜蛋白質を探すという方向で、このパラドックスを解こうと考えた。 yeast
two-hybrid法や免疫沈降法を試みたが成功せず、上記のジャンクションの単離分画に濃縮する膜蛋白質の中で、種々の条件下(超音波破壊や蔗糖密度勾配遠心)でオクルディンと挙動をともにするものを探すことにした。 その結果、最終的に、電気泳動上23kDaの分子量を示す蛋白質が候補として残ったので、そのアミノ酸配列を決定したところ、2つのESTクローンに一致した。 これらのESTクローンから全長の遺伝子を単離したところ、互いにアミノ酸レベルで約30%のホモロジーを示す2種類の23kDa蛋白質をコードするcDNAが同定された(もともとの23kDaのバンドが少なくとも2種類以上の蛋白質の混合物だったことになる)。 おもしろいことに、これらの蛋白質はそのアミノ酸配列から、やはり4回膜貫通型の内在性膜蛋白質と思われたが、オクルディンとは全くホモロジーを示さなかった
(図3)。  いずれの蛋白質もタグをつけて上皮細胞に発現させるとTJストランドに取り込まれることが分かったので、この時点でクローディン-1と-2(claudin-1,-2:ラテン語のclaudere、閉じるの意、から)と名付けた12)。
いずれの蛋白質もタグをつけて上皮細胞に発現させるとTJストランドに取り込まれることが分かったので、この時点でクローディン-1と-2(claudin-1,-2:ラテン語のclaudere、閉じるの意、から)と名付けた12)。
クローディン-1または-2をTJを持たないマウスL線維芽細胞に強制発現させると、いずれの場合も、もともと細胞間接着活性を示さないL細胞が互いに強固に接着するようになった13)。 さらに細胞間に巨大なTJストランドネットワークが形成された(図4)。 オクルディンをL細胞に発現させてもこのようなネットワークは形成されないが、クローディンと同時に導入すると、クローディンによって形成されたストランドにオクルディンが組み込まれた14)。
5.クローディン遺伝子ファミリー
クローディン-1と-2の存在は、クローディン遺伝がファミリーを形成していることを意味していた。 そこでデータベースを調べてみると、クローディン-1と-2に似たアミノ酸配列が沢山登録されていた。
これらの配列をもとに、それぞれをコードする遺伝子を同定していったところ、最終的にクローディンファミリーはマウスで少なくとも15種類のメンバーからなることが明らかになった15,16)。
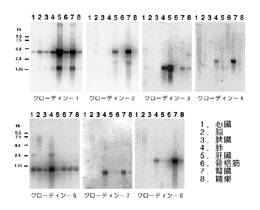 図5は、クローディン-1から-8までの各臓器における発現をノザンブロットにより調べたものであるが、それぞれのクローディンが複雑な組み合わせで各臓器で発現しているのが分かる。 例えば、クローディン-1は比較的多くの臓器で発現しているが、特に肝臓と腎臓に多い。 一方、クローディン-3の発現は肺と肝臓に限られている。 また、クローディン-6は成体では発現が見られず、胎児では多くの臓器に発現しているようである。
図5は、クローディン-1から-8までの各臓器における発現をノザンブロットにより調べたものであるが、それぞれのクローディンが複雑な組み合わせで各臓器で発現しているのが分かる。 例えば、クローディン-1は比較的多くの臓器で発現しているが、特に肝臓と腎臓に多い。 一方、クローディン-3の発現は肺と肝臓に限られている。 また、クローディン-6は成体では発現が見られず、胎児では多くの臓器に発現しているようである。
いくつかの特殊な細胞は、特殊なクローディンを発現しているということも、最近明らかになってきた。 例えば、図5に見られるようにクローディン-5は、脳、心筋、骨格筋といった上皮細胞を含まない臓器にも多く発現している。 このことから、このクローディンは血管の内皮細胞に発現しているのではないかと考え、特異抗体の作製を試みた。 その結果、予想通り、クローディン-5が血管特異的カドヘリンであるVEカドヘリンとともに、血管の内皮細胞間に濃縮していることが明らかになった17)(図6)。
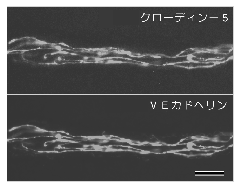 今のところ、他の種類のクローディンの発現は血管内皮細胞には見られていないので、クローディン-5が血管の透過性を規定する重要な分子である可能性が高い。 もう一つの例として、クローディンー11が挙げられる。 このクローディンは、ノザンブロットでは主に脳と精巣に発現している。 やはり特異抗体を作製して調べたところ、脳ではミエリンの細胞膜間の特殊なTJを、精巣ではセルトリ細胞間のよく発達したTJを構成していることが分かった18)。 すなわち、このクローディンは、有髄神経における跳躍伝導や、精巣における血管精巣バリアーにとって重要な分子であることが示唆された。
今のところ、他の種類のクローディンの発現は血管内皮細胞には見られていないので、クローディン-5が血管の透過性を規定する重要な分子である可能性が高い。 もう一つの例として、クローディンー11が挙げられる。 このクローディンは、ノザンブロットでは主に脳と精巣に発現している。 やはり特異抗体を作製して調べたところ、脳ではミエリンの細胞膜間の特殊なTJを、精巣ではセルトリ細胞間のよく発達したTJを構成していることが分かった18)。 すなわち、このクローディンは、有髄神経における跳躍伝導や、精巣における血管精巣バリアーにとって重要な分子であることが示唆された。
6.タイトジャンクションストランドの分子構築
前述したように、2本のTJストランドが側面で対合することによりTJのキッシングポイントが形成されている。
一方、L細胞にトランスフェクションする実験により、クローディンが線状に重合してTJストランドが形成されることが証明されている13)。 複数の種類のクローディンが一つの細胞に共発現しているとなると、対合している2本のストランドの中にこれらのクローディンはどのように組み込まれているのであろうか? 問題が複雑になるので、図7では2種類のクローディンが共発現している場合について考えてみる。
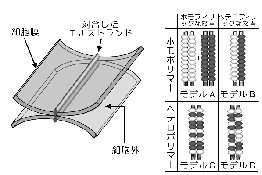 まず、それぞれのストランドが同一のクローディンからなるホモポリマーであるケースと、2種類のクローディンが共重合して(ヘテロポリマー)一本のストランドを形成しているケースが考えられる。 さらに、向かい合うストランドどうしが対合する際、同じクローディンどうしが接着するケース(ホモフィリックな接着)と、異なるクローディンどうしも接着できるケース(ヘテロフィリックな接着)が考えられる。 これらをまとめると、単純にはAからDまでの4種類のモデルが考えられる。 実際のTJでは、どのモデルが当てはまるのであろうか?
まず、それぞれのストランドが同一のクローディンからなるホモポリマーであるケースと、2種類のクローディンが共重合して(ヘテロポリマー)一本のストランドを形成しているケースが考えられる。 さらに、向かい合うストランドどうしが対合する際、同じクローディンどうしが接着するケース(ホモフィリックな接着)と、異なるクローディンどうしも接着できるケース(ヘテロフィリックな接着)が考えられる。 これらをまとめると、単純にはAからDまでの4種類のモデルが考えられる。 実際のTJでは、どのモデルが当てはまるのであろうか?
肝臓の実質細胞では、少なくともクローディン-1、-2、-3の3種類のクローディンが共発現している。 電子顕微鏡レベルの抗体染色では、これらのクローディンがTJストランドに比較的均一に混ざり合っている、すなわち、ヘテロポリマーを形成しているようにみえる。 実際、
L細胞にこれらのクローディンのうち、任意の2種類を共発現させると、確かにヘテロポリマーを作ることが証明された19)。 もちろん、クローディン-1や-2を単独で発現させてもTJストランドが再構成されるので、ホモポリマーも作り得る13)。 そこで、次に、クローディン-1だけ、またはクローディン-2だけを発現させたL細胞(それぞれC1L細胞およびC2L細胞)を、クローディン-3だけを発現させたL細胞(C3L細胞)と混ぜて培養してみたところ、C1L/C3L細胞間にもC2L/C3L細胞間にもよく発達したTJストランドネットワークが形成された。 すなわち、クローディン-1と-3、クローディン-2と-3は、それぞれヘテロフィリックに接着することにより対合したTJストランドを形成することができるのである。 したがって、4つのモデルのうち、もっとも複雑なモデルDが実際のTJで起きていると結論された19)。 すなわち、「2種類以上のクローディンが共重合してヘテロポリマーであるTJストランドを形成し、向かい合う細胞膜中のストランドどうしがクローディン間のヘテロフィリックな接着により対合して、細胞膜間の距離をゼロにしているのが、TJである」と結論できる。 ただし、実際にはオクルディンもこのTJストランドに組み込まれており、さらに複雑な分子構築が予想される。 どのようにこれらの蛋白質が配置されてTJストランドが形成されているかは今後の電子顕微鏡などを用いた構造解析を待たなければならない。
7.バリアー機能とクローディン
TJストランドの基本構造がクローディンによって構成されていることは明らかになったが、それでは、このクローディンよりなるTJストランドが上皮細胞や内皮細胞シートのバリアー機能を実際に担っているのであろうか? あるクローディンを上皮細胞に過剰発現させても、TJストランドの数(TJの発達具合)が、それぞれの上皮細胞で何らかの機構で規定されているらしく、TJストランドの数が著しく増えてバリアー機能が極端に上昇することはないようである。 一方、クローディンの発現を抑える方向の実験も、それぞれの上皮細胞に幾種類ものクローディンが発現しているために易しくないが、最近、腸内細菌の毒素を利用するというユニークな方法で、バリアー機能とクローディンの関係が明瞭に示された20)。
上述したように、クローディン-1と-2に似た分子をデータベースから探した時に、腸内細菌(Clostridium
perforingens)のペプチド性毒素のレセプター(CPE-R)21)も、クローディンファミリーの一員であるということに気付いた(現在ではクローディン-4と呼ばれている)。 この毒素は、C末端半分でレセプターに結合し、N末端半分で細胞膜に穴をあけると考えられていたので、まず、C末端側半分に相当するペプチド(C-CPE)を大腸菌で作製し、このペプチドが培養上皮細胞であるMDCK細胞のバリアー機能にどのような影響を与えるかを調べた。
 MDCK細胞には、おもに、クローディン-1と-4が発現していたが、 C-CPEはクローディン-1には結合せず、クローディン-4にだけに結合することが確認された。
興味深いことに、MDCK細胞をC-CPE存在下で培養すると、 1時間以内にそのTJからクローディン-4のみが選択的に消え始め、4時間位でクローディン-1のみからなるTJに変化した。 これに平行して、電気抵抗として測定されるバリアー機能は極端に低下した。 この時、TJストランドは、
C-CPEの存在下で、急速に溶けたように壊れ始め、最終的にストランドの数が半分以下に減ることが分かった(図8)。 このペプチドを洗い流すと、再びクローディン-4がTJに濃縮し始め、バリアー機能も回復した。 以上の結果は、クローディンがTJストランドを形成することにより、上皮細胞や内皮細胞シートのバリアー機能を直接担っていることを初めて示したものである。
MDCK細胞には、おもに、クローディン-1と-4が発現していたが、 C-CPEはクローディン-1には結合せず、クローディン-4にだけに結合することが確認された。
興味深いことに、MDCK細胞をC-CPE存在下で培養すると、 1時間以内にそのTJからクローディン-4のみが選択的に消え始め、4時間位でクローディン-1のみからなるTJに変化した。 これに平行して、電気抵抗として測定されるバリアー機能は極端に低下した。 この時、TJストランドは、
C-CPEの存在下で、急速に溶けたように壊れ始め、最終的にストランドの数が半分以下に減ることが分かった(図8)。 このペプチドを洗い流すと、再びクローディン-4がTJに濃縮し始め、バリアー機能も回復した。 以上の結果は、クローディンがTJストランドを形成することにより、上皮細胞や内皮細胞シートのバリアー機能を直接担っていることを初めて示したものである。
8.paracellular チャネルとクローディン
異なるクローディン間でヘテロフィリックな接着ができると述べたが、これは単純化しすぎていることも分かってきた。 上述したようにC1L細胞とC3L細胞の間、またはC2L細胞とC3L細胞の間にはヘテロフィリックな接着により立派なTJが形成されるが、C1L細胞とC2L細胞を混合培養しても、その間にはTJストランドが形成されないのである19)。 すなわち、クローディンの組み合わせによって、その接着強度に明らかな差があるようにみえる。 そのようなことを前提にして、モデルDを眺めてみると、このTJという構造はなかなか複雑なシステムであるということに気付く。 例えば、クローディンー1とクローディンー3でモデルDのような対合する2本のストランドを形成している場合と、クローディンー1とクローディンー2で形成している場合を考えてみよう(図9)。
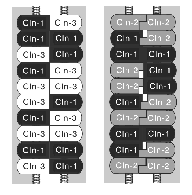 前者ではクローディンー1とー3のヘテロポリマーが対合するので、クローディンー1どうしおよびクローディンー3どうしのホモフィリックな接着と、クローディンー1とクローディンー3のヘテロフィリックな接着が混在するが、いずれも比較的強く接着する。 しかし、後者では、クローディンー1どうしおよびクローディンー2どうしのホモフィリックな接着は強いが、強制的に向かい合わされたクローディンー1とクローディンー2は強くは接着できない。 したがって、前者のTJの方が後者より強いバリアー機能を示すことが期待できる。 ぞれぞれ単独でもTJストランドを形成できる15種類ものクローディンが存在する意味は、このようなところにあるのではないだろうか? そのTJに含まれるクローディンの種類と混合の割合によって、対合するTJストランド間に作る“穴”の数と性質を変えて、TJのバリアー機能を巧みに調節しているのではないだろうか?
前者ではクローディンー1とー3のヘテロポリマーが対合するので、クローディンー1どうしおよびクローディンー3どうしのホモフィリックな接着と、クローディンー1とクローディンー3のヘテロフィリックな接着が混在するが、いずれも比較的強く接着する。 しかし、後者では、クローディンー1どうしおよびクローディンー2どうしのホモフィリックな接着は強いが、強制的に向かい合わされたクローディンー1とクローディンー2は強くは接着できない。 したがって、前者のTJの方が後者より強いバリアー機能を示すことが期待できる。 ぞれぞれ単独でもTJストランドを形成できる15種類ものクローディンが存在する意味は、このようなところにあるのではないだろうか? そのTJに含まれるクローディンの種類と混合の割合によって、対合するTJストランド間に作る“穴”の数と性質を変えて、TJのバリアー機能を巧みに調節しているのではないだろうか?
このような仮説によく合致する事実が、ごく最近、常染色体劣性遺伝形式をとる低マグネシウム血症の原因遺伝子の解析から、明らかにされた22)。 マグネシウムイオンは、腎臓の糸球体で一旦濾過され、尿中に出た後で、その大部分がヘンレの上行脚で再吸収されるが、これらの家系の患者では、この再吸収が全く行われない。 そのため、血中のマグネシウムイオン濃度が低下するという遺伝病である。 マグネシウムイオンの再吸収は、上行脚の上皮において、transcellular
pathwayではなく、大部分がpracellular pathwayを介する受動的な輸送によって担われていることが知られていた。 その原因遺伝子がポジショナルクローニング法により同定され、その遺伝子産物のアミノ酸配列が推定されてみると、驚いたことにクローディンファミリーに属することが明らかになったのである。 このクローディンは、それまで同定されていた15種類のクローディンのいずれとも一致せず、クローディンー16(遺伝子を同定したグループはparacellin-1
と呼んでいるが)というべきものであった。 このクローディンは、ヘンレの上行脚だけに発現している特殊なクローディンで、その発現がなくなると(または機能が抑制されると)paracellular
pathwayを介したマグネシウムイオンの輸送が阻害されることから、このクローディンがTJストランドの中で、マグネシウムイオンを比較的選択的に通すチャネル(穴)を形成していると考えられた。 どのようにしてこのクローディンがチャネルを形成するかは今後の問題であるが、上述したように、もし、このクローディンがヘンレの上行脚の上皮細胞に発現している他のクローディンとヘテロフィリックな接着をする上で相性が悪いと仮定すると、対合する2本のTJストランド間にクローディンー16(paracellin-1)とその相性の悪いクローディンとによって“穴”が作られ、そこをマグネシウムイオンが通ることは容易に想像できる。 このような発見により、古くからその存在が予想されていたparacellular
チャネルの実体が、クローディンそのものであることが示唆された。
9.タイトジャンクション研究の今後:まとめにかえて
この総説では、我々の研究の流れを追って、TJの接着分子、すなわちTJストランドを形成する内在性膜蛋白質について、現在までに明らかになったことをまとめてみた。 細胞間接着という現象が分子の言葉で語られるようになってから久しいが、TJという特殊な細胞間接着を司る分子の同定は遅れていた。 クローディン分子のかなりの部分が細胞膜内に埋まっているために、抗体による分子の同定や機能阻害が難しかったことも一因であったように思われる。 クローディン分子群は、発見されてから日が浅いために、まだ不明な点が多い。 しかし、TJストランドの基本的な分子構築が明らかにされた今、TJの研究はいくつかの方向に大きく発展するものと期待される。 今後の発展の方向を議論することで、この総説のまとめとしたい。
まず、第一に、本総説で詳しく述べてきたように、TJのバリア機能の分子レベルでの理解が深まるであろう。 TJのバリア機能、およびその調節機能が、多細胞生物の個体形成の上でどのように重要な役割を果たしているかが、それぞれのクローディン遺伝子のノックアウトマウスを作製することにより、明らかにされるであろう。
そして、バリアー機能の異常とさまざまな疾患・病態との関係も明らかになるであろう。 さらに、Clostridium
perforingensの毒素の実験でも明らかなように、TJのバリアー機能を人為的に操作する方法が確立され、脳血管関門などを一時的に破壊することが可能となり、ドラッグデリバリー法の開発の上でも大きな進歩をもたらすであろう。 すなわち、これまでのtranscellular
pathwayの生理学に対して、全く新しいparacellular pathwayの生理学の発展とその応用が期待できる。
第二に、ここでは全く触れなかったことであるが、上皮細胞や内皮細胞の極性形成におけるTJの役割の理解も分子レベルで深まるであろう。 TJストランドは、アピカル膜ドメインとバソラテラル膜ドメインの間に、オイルフェンスのように張り巡らされているため、二つのドメインを分ける役割(フェンス機能)を果たしていると想定されてきた2)。 この想定そのものが正しいかどうか、クローディンが同定された今、実験的に検証できるであろう。 また、TJストランドの細胞質側には、オクルディン・クローディンと直接結合するZO-1、ZO-2、ZO-3などの裏打ち蛋白質の他に23,24)、種々の上皮細胞の形態形成シグナルを担うと思われる因子が集積していることが最近明らかになりつつある25)。 このようなシグナル伝達のセンターの一つとしてのTJの役割の解析も今後の重要な方向であろう。
一方で、オクルディンの機能は依然として謎に包まれている。 オクルディンノックアウトマウスは、一見正常に生まれるが、その後の成長が遅く、胃、唾液腺、脳、骨などにそれぞれ特徴的な病変を生じ、子孫を残すことができない(斉藤ら、投稿準備中)。 このマウスは、
まだ我々が全く知らない重要な役割をTJが果たしていることを強く示唆している。 TJの周辺には、まだまだ、多くの謎解きの楽しみが残っている。
この研究は、都臨床研・国立生理研以来の仲間であり、現在の我々の研究室のスタッフである月田早智子、米村重信、永渕昭良、伊藤雅彦の各博士が進めてきた細胞間接着装置の分子生物学的研究の延長線上に、各博士の協力により生まれてきたものであり、ここに深く感謝します。 また、ここに紹介した研究の多くは、大学院生により進められたものであることを記し、感謝の意を表します。
(補)本文を書き上げてから印刷までの間に、クローディン-11のノックアウトマウスが報告された [Grow,A., Southwood,C.M.,
Li,J.S., Pariali,M., Riordan,G.P., Brodie,S.E., Danias,J., Bronstein,J.M.,
Kachar,B. & Lazzarinin,R.A. (1999) Cell 99,649-659]。 クローディン-11はOSP(oligodendrocyte
specific protein)として1996年に遺伝子として報告されていたものであるが、この遺伝子産物がTJの構成因子であることが分かる以前から、この遺伝子の機能解析の一環としてアメリカのグループによりノックアウトマウスの作製が進められていたらしい。 本文中で述べたように、このクローディンは中枢神経のミエリンと精巣のセルトリ細胞のTJに特異的に存在している特殊なものであることを我々は報告していたが18)、予想通りこのマウスではこれらの細胞からTJが消えており、有髄神経の伝導速度の低下と精子形成不全が観察された。 これがクローディンファミリーのメンバーのノックアウトマウスとしては最初の報告であり、クローディンの重要性が個体レベルで証明されたことになる。 また、2000年1月の段階で、クローディンは18種類まで同定されている。
文 献
1) Claude, P. (1978) J. Membr. Biol. 10, 219-232
2) Gumbiner, B. (1993) J. Cell Biol. 123, 1631-1633
3) Farquhar, M.G., & Palade, G.E. (1963) J. Cell Biol.
17, 375-412
4) Staehelin, L.A. (1974) Int. Rev. Cytol. 39, 191-283
5) Pinto da Silva, P., & Kachar, B. (1982) Cell 28,
441-450
6) Tsukita, Sh., & Tsukita, Sa. (1989) J. Cell Biol. 108,
31-41
7) Itoh, M., Nagafuchi, A., Yonemura, S., Kitani-Yasuda, T., Tsukita,
Sa., & Tsukita, Sh. (1993) J. Cell Biol. 121,
491-502
8) Furuse, M., Hirase, T., Itoh, M., Nagafuchi, A., Yonemura,
S., Tsukita, Sa., & Tsukita, Sh. (1993) J.Cell Biol.
123, 1777-1788
9) Ando-Akatsuka, Y., Saitou, M., Hirase, T., Kishi, M., Sakakibara,
A., Itoh, M., Yonemura, S., Furuse, M., & Tsukita, Sh. (1996)
J. Cell Biol. 133, 43-47
10) Matter, K., & Balda, M. (1999) Int. Rev. Cytol. 186,
117-146
11) Saitou, M., Fujimoto, K., Doi, Y., Itoh, M., Fujimoto, T.,
Furuse, M., Takano, H., Noda, T., & Tsukita. Sh. (1998) J.Cell
Biol. 141, 397-408
12) Furuse, M., Fujita, K., Hiiragi, T., Fujimoto, K., & Tsukita,
Sh. (1998) J. Cell Biol. 141, 1539-1550
13) Kubota, K., Furuse, M., Sasaki, H., Sonoda, N., Fujita, K.,
Nagafuchi, A., & Tsukita, Sh. (1999) Curr Biol. 9,
1035-1038
14) Furuse, M., Sasaki, H., Fujimoto, K., & Tsukita, Sh. (1998)
J. Cell Biol. 143, 391-401
15) Morita, K., Furuse, M., Fujimoto, K., & Tsukita, Sh. (1999)
Proc. Natl. Acad. Sci. USA 96, 511-516
16) Tsukita, Sh., & Furuse, M. (1999) Trend. Cell Biol.
9, 268-273
17) Morita, K., Sasaki, H., Furuse, M., & Tsukita, Sh. (1999)
J.Cell Biol. 147, 185-194
18) Morita, K., Sasaki, H., Fujimoto, K., Furuse, M., & Tsukita.
Sh. (1999) J. Cell Biol. 145, 579-788
19) Furuse, M., Sasaki, H., & Tsukita, Sh. (1999) J. Cell
Biol. in press.
20) Sonoda, N., Furuse, M., Sasaki, H., Yonemura, S., Katahira,
J., Horiguchi, Y., & Tsukita, Sh. (1999) J. Cell Biol.
147, 195-204
21) Katahira, J., Inoue, N., Horiguchi, Y., Matsuda, M., &
Sugimoto, N. (1997) J. Cell Biol. 136, 1239-1247
22) Simon, D.B., Lu, Y., Choate, K.A., Velazquez, H., Al-Sabban,
E., Praga, M., Casari, G., Bettinelli, A., Colussi, G., Rodriguez-Soriano,
J., McCredie, D., Milford, D., Sanjad, & S., Lifton, R.P.
(1999) Science 285, 103-106
23) Furuse, M., Itoh, M., Hirase, T., Nagafuchi, A., Yonemura,
S., Tsukita, Sa., and Tsukita, Sh. (1994) J. Cell Biol. 127,
1617-1626
24) Itoh, M., Furuse, M., Saitou, M., Morita, K., Kubota, K.,
and Tsukita, Sh. (1999) J. Cell Biol. in press
25) Tsukita, Sh., Furuse, M., & Itoh, M. (1999) Curr. Opin.
Cell Biol. 11, 628-633
JCB 2000年 4月号掲載
Pores in the Wall: Claudins Constitute
Tight Junction Strands
Containing Aqueous Pores
Shoichiro Tsukita and Mikio Furuse
In vertebrates, tight junctions (TJs)
play a central role in sealing the intercellular space in epithelial
and endothelial cellular sheets (Anderson and Van Itallie, 1995;
Gumbiner, 1993; Schneeberger and Lynch, 1992). Without TJs, these
cellular sheets cannot function as barriers to establish compositionally
distinct fluid compartments. To maintain homeostasis, various
materials must be selectively transported across these cellular
sheets: Two distinct pathways are known for this transport, the
transcellular and paracellular pathways in which materials move
across plasma membranes and TJs, respectively (Spring, 1998) (Fig.1).
 The molecular machinery involved in transport through the
transcellular pathway, i.e. channels, pumps, transporters etc.,
have been identified and well characterized in molecular terms.
In sharp contrast, our knowledge regarding paracellular transport
is limited mainly due to the lack of information on the molecular
architecture of TJs. However, recent identification of TJ-specific
integral membrane proteins prompted us to consider the molecular
mechanism behind the barrier of TJs as well as transport across
TJs.
The molecular machinery involved in transport through the
transcellular pathway, i.e. channels, pumps, transporters etc.,
have been identified and well characterized in molecular terms.
In sharp contrast, our knowledge regarding paracellular transport
is limited mainly due to the lack of information on the molecular
architecture of TJs. However, recent identification of TJ-specific
integral membrane proteins prompted us to consider the molecular
mechanism behind the barrier of TJs as well as transport across
TJs.
Fig.1 shows the structural aspects of TJs. The key structure in
TJs is the メTJ strandモ (or fibril) within plasma membranes, which
was visualized by freeze-fracture replica electron microscopy
(Staehelin, 1973). Each TJ strand laterally and tightly associates
with that in the apposing membrane of adjacent cells to form a
メpaired strandモ, where the intercellular space is obliterated
(so-called メkissing pointsモ of plasma membranes in ultrathin sectional
images) (Farquhar and Palade, 1963). This paired strand has been
suggested to be responsible for the intercellular sealing in epithelial/endothelial
cellular sheets. Furthermore, detailed electrophysiological analyses
suggested the existence of aqueous pores within the paired TJ
strands (Fig.1) (Diamond, 1977; Claude, 1978; Reuss 1992; Gumbiner,
1993). This mini-review will present an overview of the recent
progress in our understanding of the structure and functions of
TJ strands in molecular terms.
Claudins Constitute Paired TJ Strands
TJ strands have been suggested by some investigators to
be predominantly lipidic in nature, i.e. inverted cylindrical
lipid micelles (Pinto da Silva and Kachar, 1982; Kachar and Reese,
1982; Verkleij, 1984), but many cell biologists have long searched
for proteinous components constituting TJ strands. Thus, when
occludin, a novel ~65 kD integral membrane protein with four transmembrane
domains, was identified as the first component of TJ strands (Furuse
et al., 1993; Ando-Akatsuka et al., 1996), this identification
was regarded as the メHolly Grailモ in this field (Gumbiner, 1993),
and successive studies emphasized the importance of occludin in
the structure and functions of TJs (McCarthy et al., 1996; Balda
et al., 1996; Chen et al., 1997; Wong and Gumbiner, 1997). However,
it has gradually become clear that the molecular architecture
of TJ strands is more complex than expected (Balda et al., 1996;
Hirase et al., 1997; Moroi et al., 1998). Especially, the fact
that the occludin-deficient visceral endoderm cells still bear
well developed network of TJ strands indicated that as yet unidentified
membrane proteins or lipid molecules constitute TJ strands (Saitou
et al., 1998).
In 1998, two novel integral membrane
proteins (~23 kD) with four transmembrane domains were identified
from the junction-enriched fraction as components that co-partitioned
with occludin (Fig.2) (Furuse et al., 1998a). 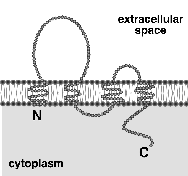 These proteins, named claudin-1 and -2, were structurally
related (~30% identical at the amino acid sequence level) but
showed no sequence similarity to occludin. The most characteristic
feature of these molecules was that they reconstituted TJs in
fibroblasts when singly transfected (Furuse et al., 1998b). The
reconstituted TJs were morphologically indistinguishable from
those in situ, although they were not zonula but
puncta occludens; ultrathin and freeze-fracture replica
electron microscopy identified the formation of kissing points
and paired strands, respectively, between adjacent transfectants
(Kubota et al., 1999; Furuse et al., 1998b).
These proteins, named claudin-1 and -2, were structurally
related (~30% identical at the amino acid sequence level) but
showed no sequence similarity to occludin. The most characteristic
feature of these molecules was that they reconstituted TJs in
fibroblasts when singly transfected (Furuse et al., 1998b). The
reconstituted TJs were morphologically indistinguishable from
those in situ, although they were not zonula but
puncta occludens; ultrathin and freeze-fracture replica
electron microscopy identified the formation of kissing points
and paired strands, respectively, between adjacent transfectants
(Kubota et al., 1999; Furuse et al., 1998b).
Another integral membrane protein with a single membrane-spanning
domain, named JAM, was shown to be localized at TJs (Martin-Padura
et al., 1998). Although the nature of this molecule has remained
elusive, preliminary freeze-fracture replica analyses indicated
that this molecule itself has no ability to reconstitute TJ strands
in fibroblasts (Itoh, unpublished data).
The Claudin Family, A Newly Emerging Gene Family
Identification of claudin-1 and -2 indicated the existence
of a novel gene family. To date, 18 members of this claudin family
have been identified, and the list of claudins is still increasing
(Morita et al., 1999a; Simon et al., 1999; Tsukita and Furuse,
1999). Some of these molecules were previously identified as RVP1
(claudin-3; Briehi and Miesfeld, 1991), CPE-R (claudin-4; Katahira
et al., 1997), TMVCF (claudin-5; Sirotkin et al., 1997) and OSP
(claudin-11; Bronstein et al., 1996), although their physiological
functions have remained unclear. All of these claudin family members
have not yet been examined in detail, but the data obtained to
date by immunolabeling and/or transfection experiments favored
the notion that all members of the claudin family are directly
involved in the formation of TJ strands in situ.
Northern blotting showed that tissue distribution patterns of
each claudin member are distinct (Furuse et al., 1998a; Morita
et al., 1999a). For example, claudin-1 and -2 are expressed at
high levels in the liver and kidney, whereas claudin-3 mRNA is
detected mainly in the lung and liver. Claudin-4, -7 and -8 are
primarily expressed in the lung and kidney. These findings together
with those of immunofluorescence microscopy suggested that in
various tissues more than two species of claudins are co-expressed
in single cells. On the other hand, it also became clear that
some types of cells express their own specific claudin species.
One example is claudin-5/TMVCF, which consists of TJ strands specifically
in endothelial cells of blood vessels (Morita et al., 1999c).
To date, claudin-5/TMVCF has not been found in non-endothelial
cells. Another example is claudin-11/OSP, which is primarily expressed
in the brain and testis. This claudin species was shown to constitute
TJ strands between lamellae of myelin sheaths of oligodendrocytes
in the brain, and those between adjacent Sertoli cells in the
testis (Morita et al., 1999b). Recently, claudin-11/OSP-deficient
mice were successfully generated (Gow et al., 1999). In these
mice, TJ strands were absent in myelin sheaths of oligodendrocytes
and Sertoli cells, conclusively indicating that in these types
of cells TJ strands are mainly composed of a single specific claudin,
claudin-11/OSP. These findings naturally raised questions
regarding the physiological relevance of the existence of so many
claudin species. This point will be discussed later.
Claudins Are Functionally Involved in the TJ Barrier
Now that the paired TJ strands can be reconstituted from
a single gene product, claudin, the relationship between the TJ
strand formation and the TJ barrier function could be experimentally
evaluated. However, as noted above, since the reconstituted TJs
did not surround individual fibroblast transfectants continuously,
the barrier function of these TJs could not be measured using
these cellular sheets. Gene knock-out is a promising approach
to analyze the functions of TJs as recently shown in claudin-11/OSP-deficient
mice (Gow et al., 1999), but it is technically difficult to directly
examine the barrier functions of TJs in mice in detail.
Recently, to solve these technical difficulties, the bacterial
peptide toxin, Clostridium perfringens enterotoxin (CPE),
was utilized (Sonoda et al., 1999). As described above, claudin-4
was initially identified as a CPE receptor (CPE-R), and it was
reported that the COOH-terminal half of this peptide (C-CPE) specifically
bound to claudin-4/CPE-R (Katahira et al., 1997). When this C-CPE
was applied to cultured epithelial cells, MDCK cells that express
mainly claudin-1 and -4, claudin-4 was specifically removed from
TJs with a concomitant decrease in TER (transepithelial electrical
resistance) as well as in the number of TJ strands. These findings
provided concrete evidence of the direct involvement of claudins
in the barrier functions of TJs.
We have now concluded that claudins constitute the メwallモ between
adjacent epithelial/endothelial cells, which is responsible for
sealing in the paracellular pathway. As noted above, however,
in situ this wall contains メporesモ, leading to the question
of the chemical natures of these pores.
Aqueous Pores within TJ Strands
Analysis of hereditary hypomagnesemia yielded insight
that may allow us to answer this question. The renal resorption
of Mg++ is known to occur predominantly through the paracellular
pathway in the thick ascending limb of Henle, but in these patients
this paracellular flux is blocked, resulting in severe hypomagnesemia.
Positional cloning has identified a member of the claudin family
(claudin-16/paracellin-1) as a gene responsible for this disease
(Simon et al., 1999), and this claudin species was shown to be
exclusively expressed in the thick ascending limb of Henle. This
finding led to a very intriguing conclusion: Claudin-11/paracellin-1
is directly involved in a selective paracellular conductance for
Mg++ ions of claudin-based TJ strands.
It is possible that only claudin-16/paracellin-1, but not other
claudins, can form pores through its homotypic interaction on
the claudin-based wall. However, as the permeability properties
of individual paired TJ strands appear to be fairly variable in
different epithelia (Diamond, 1977; Gumbiner, 1993), it is more
likely that most claudin species can constitute not only the wall
but also the pores in the wall. Recent detailed analyses of the
manner of interaction of heterogeneous claudin species within
and between the paired TJ strands provided important information
to clarify this point (Furuse et al., 1999). [1] When two of claudin-1,
-2 and -3 were co-expressed in L fibroblasts, claudins were co-polymerized
into individual TJ strands (heteropolymers) in any combination
(Fig.3a). [2] When two of L transfectants singly expressing claudin-1,
-2 or -3 were co-cultured, claudin-3-based strands (homopolymers)
laterally associated with claudin-1- or claudin-2-based strands
(homopolymers) in a heterotypic manner, but such heterotypic paired
strands were not formed between claudin-1- and claudin-2-based
strands (Fig.3b). 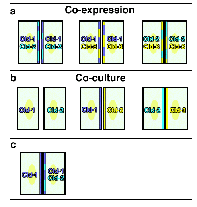 [3] When L transfectants singly expressing claudin-1 were
co-cultured with those co-expressing
claudin-1 and -2, claudin-1 homopolymers laterally associated
with claudin-1/2 heteropolymers to form paired strands (Furuse,
unpublished data) (Fig.3c). These observations suggested a possible
explanation as to how claudins constitute the wall and the pore
simultaneously. In Fig.4, two types of paired strands are supposed,
claudin-1/3-based and claudin-1/2-based paired strands, in which
individual strands, i.e. heteropolymers consisting of claudin-1&-3
or claudin-1&-2, respectively, are laterally associated. In
the former type of paired strands, claudin-1 and -3 could adhere
both in homotypic and heterotypic manners (see Fig.3b). However,
in the latter type, claudin-1 could not adhere with claudin-2
in a heterotypic manner, resulting in the formation of メporesモ
within paired strands. This is purely speculative at this stage,
but as in situ TJ strands are composed of various combinations
of at least 18 claudin species, it is tempting to hypothesize
that the tightness of paired TJ strands is determined by the number/type
of species of claudins and their mixing ratio in strands.
[3] When L transfectants singly expressing claudin-1 were
co-cultured with those co-expressing
claudin-1 and -2, claudin-1 homopolymers laterally associated
with claudin-1/2 heteropolymers to form paired strands (Furuse,
unpublished data) (Fig.3c). These observations suggested a possible
explanation as to how claudins constitute the wall and the pore
simultaneously. In Fig.4, two types of paired strands are supposed,
claudin-1/3-based and claudin-1/2-based paired strands, in which
individual strands, i.e. heteropolymers consisting of claudin-1&-3
or claudin-1&-2, respectively, are laterally associated. In
the former type of paired strands, claudin-1 and -3 could adhere
both in homotypic and heterotypic manners (see Fig.3b). However,
in the latter type, claudin-1 could not adhere with claudin-2
in a heterotypic manner, resulting in the formation of メporesモ
within paired strands. This is purely speculative at this stage,
but as in situ TJ strands are composed of various combinations
of at least 18 claudin species, it is tempting to hypothesize
that the tightness of paired TJ strands is determined by the number/type
of species of claudins and their mixing ratio in strands. 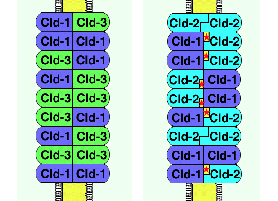
Perspective
Individual TJ strands (paired TJ strands) differ in permeability
depending on cell type. For example, as a model system, the tightness
of MDCK cells has been compared between type I and II clones;
MDCK I cells have a fairly tighter TJ barrier than MDCK II cells,
but no significant difference was detected in the number of TJ
strands between these two clones (Stevenson et al., 1988). In
this mini-review, we proposed a model that may explain the variation
of the tightness of individual paired TJ strands based on the
combination of claudin species. This model may be oversimplified.
In most of the TJ strands in situ, occludin is incorporated
in the claudin-based strands (Fujimoto, 1995; Furuse et al., 1998b).
It is not clear how claudins and occludin are arranged to form
individual TJ strands. Furthermore, the information is not available
regarding the stability of individual TJ strands. If TJ strands
are repeatedly broken and annealed dynamically, their stability
would also be an important determinant of the tightness of individual
strands. In this connection, the interaction between claudins/occludin
and the underlying cytoskeleton should be analyzed in detail (Anderson
and Van Itallie, 1995; Tsukita et al., 1999; Itoh et al., 1999).
The tightness of TJs is determined not only at the level of individual
strands but also at that of strand networks (Claude and Goodenough,
1973; Madara and Dharmsathaphorn, 1985). The number of strands
as well as the frequency of their ramification have been shown
to be important factors to determine the tightness of TJs. However,
it remains unclear as to what regulates these factors in molecular
terms. As the network pattern of reconstituted claudin-based strands
in L fibroblasts differs significantly depending on claudin-species,
the combination and the mixing ratio of claudin species appear
to also be crucial in regulating the tightness of TJs at the level
of the network (Furuse et al., 1998b; Morita et al., 1999b,c).
In this connection, the regulation of individual claudin species
should be examined in detail not only at the transcriptional but
also at the posttranscriptional levels. We are now in a position
to begin exploring the molecular mechanism behind the determination
and regulation of tightness of TJs, i.e. the transport of materials
across TJs.
References
Anderson,J.M. and C.M.van Itallie. 1995. Tight junctions
and the molecular basis for
regulation of paracellular permeability. Am.J.Physiol. 269:G467-G475.
Ando-Akatsuka,Y., M.Saitou, T.Hirase, M.Kishi, A.Sakakibara, M.Itoh,
S.Yonemura,
M.Furuse, and Sh.Tsukita. 1996. Interspecies diversity of the
occludin sequence:
cDNA cloning of human, mouse, dog, and rat-kangaroo homologues.
J.Cell Biol.
133:43-47.
Balda,M.S., J.A.Whitney, C.Flores, S.Gonz㌫ez, M.Cereijido, and
K.Matter. 1996.
Functional dissociation of paracellular permeability and transepithelial
electrical
resistance and disruption of the apical-basolateral intramembrane
diffusion barrier by
expression of a mutant tight junction membrane protein. J.Cell
Biol. 134:1031-1049.
Briehl,M.M., and R.L.Miesfeld. 1991. Isolation and characterization
of transcripts induced by androgen withdrawal and apoptotic cell
death in the rat ventral prostate. Mol.Endocrinol.
5:1381-1388.
Bronstein,J.M., P.Popper, P.E.Micevych, and D.B.Farber. 1996.
Isolation and
characterization of a novel oligodendrocyte-specific protein.
Neurology 47:772-778.
Chen,Y.-H., C.Merzdorf, D.L.Paul, and D.A.Goodenough. 1997. COOH
terminus of
occludin is required for tight junction barrier function in early
Xenopus embryos.
J.Cell Biol. 138:891-899.
Claude,P. 1978. Morphological factors influencing transepithelial
permeability: a model for the resistance of the zonula occludens.
J.Membr.Biol. 10: 219-232.
Claude,P. and D.A.Goodenough. 1973. Fracture faces of zonulae
occludentes from メtightモ and メleakyモ epithelia. J.Cell Biol.
58:390-400.
Diamond,J. 1977. The epithelial junction: bridge, gate, and fence.
Physiologist. 20:10-18.
Farquhar,M.G., and G.E.Palade. 1963. Junctional complexes in various
epithelia.
J.Cell Biol. 17:375-412.
Fujimoto,K. 1995. Freeze-fracture replica electron microscopy
combined with SDS
digestion for cytochemical labeling of integral membrane proteins.
Application to the
immunogold labeling of intercellular junctional complexes. J.Cell
Sci. 108:3443-
3449.
Furuse,M., K.Fujita, T.Hiiragi, K.Fujimoto, and Sh.Tsukita. 1998a.
Claudin-1 and -2:
Novel integral membrane proteins localizing at tight junctions
with no sequence
similarity to occludin. J.Cell Biol. 141: 1539-1550.
Furuse,M., T.Hirase, M.Itoh, A.Nagafuchi, S.Yonemura, Sa.Tsukita,
and Sh.Tsukita.
1993. Occludin: a novel integral membrane protein localizing at
tight junctions.
J.Cell Biol. 123:1777-1788.
Furuse,M., H.Sasaki, K.Fujimoto, and Sh.Tsukita. 1998b. A single
gene product,
claudin-1 or -2, reconstitutes tight junction strands and recruits
occludin in fibroblasts. J.Cell Biol. 143:391-401.
Furuse,M., H.Sasaki, and Sh.Tsukita. 1999. Manner of interaction
of heterogeneous claudin species within and between tight junction
strands. J.Cell Biol. 147:891-903.
Gow,A., C.M.Southwood, J.S.Li, M.Pariali, G.P.Riordan, S.E.Brodie,
J.Danias, J.M.Bronstein, B.Kachar, and R.A.Lazzarini. 1999. CNS
myelin and Sertoli cell tight junction strands are absent in OSP/claudin-11
null mice. Cell 99:649-659.
Gumbiner,B. 1993. Breaking through the tight junction barrier.
J.Cell Biol. 123:
1631-1633.
Hirase,T, J.M.Staddon, M.Saitou, Y.Ando-Akatsuka, M.Itoh, M.Furuse,
K.Fujimoto, Sh.Tsukita, and L.L.Rubin. 1997. Occludin as a possible
determinant of tight junction permeability in endothelial cells.
J.Cell Sci. 110:1603-1613.
Itoh,M., M.Furuse, K.Morita, K.Kubota, and Sh.Tsukita. 1999. Direct
binding of three tight junction-associated MAGUKs, ZO-1, ZO-2
and ZO-3, with the COOH-termini of claudins. J.Cell Biol. 147:1351-1363.
Kachar,B. ,and T.S.Reese. 1982 . Evidence for the lipidic nature
of tight junction
strands. Nature 296:464-466.
Katahira,J., N.Inoue, Y.Horiguchi, M.Matsuda, and N.Sugimoto.
1997. Molecular cloning and functional characterization of the
receptor for Clostridium perfringens enterotoxin. J.Cell Biol.
136:1239-1247.
Kubota,K., M.Furuse, H.Sasaki, N.Sonoda, K.Fujita, A.Nagafuchi
and Sh.Tsukita. 1999. Ca++-independent cell adhesion activity
of claudins, integral membrane proteins of tight junctions. Curr.Biol.
9:1035-1038.
Madara,J.L. and K.Dharmsathaphorn. 1985. Occluding junction structure-function
relationships in a cultured epithelial monolayer. J.Cell Biol.
101:2124-2133.
Martin-Padura,I., S.Lostaglio, M.Schneemann, L.Williams, M.Romano,
P.Fruscella, C.Panzeri, A.Stoppacciaro, L.Ruco, A.Villa, D.Simmons,
and E.Dejana. 1998. Junctional adhesion molecule, a novel member
of the immunoglobulin superfamily that distributes at intercellular
junctions and modulates monocyte transmigration. J.Cell Biol.
142:117-127.
McCarthy,K.M., I.B.Skare, M.C.Stankewich, M.Furuse, Sh.Tsukita,
R.A.Rogers,
R.D.Lynch, and E.E.Schneeberger. 1996. Occludin is a functional
component of the
tight junction. J.Cell Sci. 109:2287-2298.
Morita,K., M.Furuse, K.Fujimoto, and Sh.Tsukita. 1999a. Claudin
multigene family encoding four-transmembrane domain protein components
of tight junction strands. Proc.Natl.Acad.Sci.USA 96:511-516.
Morita,K., H.Sasaki, K.Fujimoto, M.Furuse, and Sh.Tsukita. 1999b.
Claudin-11/OSP-based tight junctions in myelinated sheaths of
oligodendrocytes and Sertoli cells in testis. J.Cell Biol.
145:579-588.
MoritaK., H.Sasaki, M.Furuse, and Sh.Tsukita. 1999c. Endothelial
claudin: Claudin-5/TMVCF constitutes tight junction strands in
endothelial cells. J.Cell Biol. 147:185-194.
Moroi,S., M.Saitou, K.Fujimoto, A.Sakakibara, M.Furuse, O.Yoshida,
and Sh.Tsukita. 1998. Occludin is concentrated at tight junctions
of mouse/rat but not human/guinea pig Sertoli cells in testes.
Am.J.Physiol. 274:C1708-C1717.
Pinto da Silva,P., and B.Kachar. 1982. On tight junction structure.
Cell 28:441-450.
Reuss,L. 1992. Tight junction permeability to ions and water.
In メTight Junctionsモ (Cereijido,M. ed.) p.49-66, CRC press,
London.
Saitou,M., K.Fujimoto, Y.Doi, M.Itoh, T.Fujimoto, M.Furuse, H.Takano,
T.Noda, and
Sh.Tsukita. 1998. Occludin-deficient embryonic stem cells can
differentiate into
polarized epithelial cells bearing tight junctions. J.Cell
Biol. 141:397-408.
Schneeberger,E.E., and R.D.Lynch. 1992. Structure, function, and
regulation of
cellular tight junctions. Am.J.Physiol. 262:L647-L661.
Simon,D.B., Lu,Y., Choate,K.A., Velazquez,H., Al-Sabban,E. et
al. 1999. Paracellin-1, a renal tight junction protein required
for paracellular Mg2+ resorption. Science 285:103-106.
Sirotkin,H., B.Morrow, B.Saint-Jore, A.Puech, R.Das Gupta, S.R.Patanjali,
A.Skoultchi,
S.M.Weissman, and R.Kucherlapati. 1997. Identification, characterization,
and precise
mapping of a human gene encoding a novel membrane-spanning protein
from the 22q11 region deleted in Velo-Cardio-Facial syndrome.
Genomics. 42:245-251.
Sonoda,N., M.Furuse, H.Sasaki, S.Yonemura, J.Katahira, Y.Horiguchi,
and Sh.Tsukita. 1999. Clostridium perfringens enterotoxin fragment
removes specific claudins from tight junction strands: Evidence
for direct involvement of claudins in tight junction barrier.
J.Cell Biol. 147:195-204.
Spring,K. 1998. Routes and mechanism of fluid transport by epithelia.
Annu Rev Physiol 60:105-119.
Staehelin,L.A. 1973. Further observations on the fine structure
of freeze-cleaved tight
junctions. J.Cell Sci. 13:763-786.
Stevenson,B.R., J.M.Anderson, D.A.Goodenough, and M.S.Mooseker.
1988. Tight junction structure and ZO-1 content are identical
in two strains of Madin-Darby canine kidney cells which differ
in transepithelial resistance. J.Cell Biol. 107:2401-2408.
Tsukita,Sh. and M.Furuse. 1999. Occludin and claudins in tight
junction strands:
Leading or supporting players? Trend.Cell Biol. 9:268-273.
Tsukita,Sh., M.Furuse, and M.Itoh. 1999. Structural and signaling
molecules come together at tight junctions. Curr.Opin.Cell
Biol. 11:628-633.
Verkleij,A.J. 1984. Lipidic intramembranous particles. Biochim.Biophys.Acta
A.
779:43-63.
Wong,V., and B.M.Gumbiner. 1997. A synthetic peptide corresponding
to the
extracellular domain of occludin perturbs the tight junction permeability
barrier.
J.Cell Biol. 136:399-409.

 このpathwayはこれまでの生理学研究の中心的テーマであった。 一方、細胞間、すなわちTJを横切って運ばれるルートはparacellualr
pathwayと呼ばれる。 TJがバリアーのために存在するという、先の議論と一見矛盾するようであるが、実際にはTJのバリアー機能は、きわめてtightなものから、かなりleakyなものまで相当の幅があり、一般的にTJは選択的にイオンなどを通しうるバリアーであると言うことができる。 すなわちTJはparacellular
channelとでも言うべき“穴”を内包すると考えられるのである1)。 物質によっては主にparacellular pathwayを通って部屋の内外で交換されることも知られており、このpathwayもtranscellualr
pathwayと同様に重要であると考えられてきた。 しかし、TJの分子的基盤に関する我々の知識がきわめて未熟であったために、その解析は遅れていた2)。
このpathwayはこれまでの生理学研究の中心的テーマであった。 一方、細胞間、すなわちTJを横切って運ばれるルートはparacellualr
pathwayと呼ばれる。 TJがバリアーのために存在するという、先の議論と一見矛盾するようであるが、実際にはTJのバリアー機能は、きわめてtightなものから、かなりleakyなものまで相当の幅があり、一般的にTJは選択的にイオンなどを通しうるバリアーであると言うことができる。 すなわちTJはparacellular
channelとでも言うべき“穴”を内包すると考えられるのである1)。 物質によっては主にparacellular pathwayを通って部屋の内外で交換されることも知られており、このpathwayもtranscellualr
pathwayと同様に重要であると考えられてきた。 しかし、TJの分子的基盤に関する我々の知識がきわめて未熟であったために、その解析は遅れていた2)。 では中間径フィラメントが結合している。 これら2つの接着装置では向かい合う細胞膜間の距離は15-20 nmに保たれている。 細胞間の強い機械的結合を担っており、その結合力を細胞骨格につなげることにより、組織全体としての機械的強度をも担っている。 これらに較べ、TJは特殊な接着装置である。 超薄切片像で見ると、ところどころで向かい合う細胞膜間の距離がゼロにまで近づいている3)(TJのキッシングポイントと呼ばれる)(図2B)。 また、凍結割断レプリカ法で観察すると、TJの部分では、膜内粒子が一列に並んだストランド(TJストランド)が編み目を構成している4)(図2C)。 このような観察から、TJの構造は図2Aのようなものであると想像されてきた。 すなわち、何らかの内在性膜蛋白質が細胞膜の中で線状に重合してTJストランドを形成し、向かい合う細胞膜中のTJストランドと側面で対合することによりキッシングポイントを形成するという構造である。 しかし、このTJストランドを構成する内在性膜蛋白質の実体は長い間謎に包まれており、TJストランドが特殊な脂質の逆ミセルから出来ているという脂質説も有力視されて続けてきた5)。
では中間径フィラメントが結合している。 これら2つの接着装置では向かい合う細胞膜間の距離は15-20 nmに保たれている。 細胞間の強い機械的結合を担っており、その結合力を細胞骨格につなげることにより、組織全体としての機械的強度をも担っている。 これらに較べ、TJは特殊な接着装置である。 超薄切片像で見ると、ところどころで向かい合う細胞膜間の距離がゼロにまで近づいている3)(TJのキッシングポイントと呼ばれる)(図2B)。 また、凍結割断レプリカ法で観察すると、TJの部分では、膜内粒子が一列に並んだストランド(TJストランド)が編み目を構成している4)(図2C)。 このような観察から、TJの構造は図2Aのようなものであると想像されてきた。 すなわち、何らかの内在性膜蛋白質が細胞膜の中で線状に重合してTJストランドを形成し、向かい合う細胞膜中のTJストランドと側面で対合することによりキッシングポイントを形成するという構造である。 しかし、このTJストランドを構成する内在性膜蛋白質の実体は長い間謎に包まれており、TJストランドが特殊な脂質の逆ミセルから出来ているという脂質説も有力視されて続けてきた5)。
 いずれの蛋白質もタグをつけて上皮細胞に発現させるとTJストランドに取り込まれることが分かったので、この時点でクローディン-1と-2(claudin-1,-2:ラテン語のclaudere、閉じるの意、から)と名付けた12)。
いずれの蛋白質もタグをつけて上皮細胞に発現させるとTJストランドに取り込まれることが分かったので、この時点でクローディン-1と-2(claudin-1,-2:ラテン語のclaudere、閉じるの意、から)と名付けた12)。 図5は、クローディン-1から-8までの各臓器における発現をノザンブロットにより調べたものであるが、それぞれのクローディンが複雑な組み合わせで各臓器で発現しているのが分かる。 例えば、クローディン-1は比較的多くの臓器で発現しているが、特に肝臓と腎臓に多い。 一方、クローディン-3の発現は肺と肝臓に限られている。 また、クローディン-6は成体では発現が見られず、胎児では多くの臓器に発現しているようである。
図5は、クローディン-1から-8までの各臓器における発現をノザンブロットにより調べたものであるが、それぞれのクローディンが複雑な組み合わせで各臓器で発現しているのが分かる。 例えば、クローディン-1は比較的多くの臓器で発現しているが、特に肝臓と腎臓に多い。 一方、クローディン-3の発現は肺と肝臓に限られている。 また、クローディン-6は成体では発現が見られず、胎児では多くの臓器に発現しているようである。 今のところ、他の種類のクローディンの発現は血管内皮細胞には見られていないので、クローディン-5が血管の透過性を規定する重要な分子である可能性が高い。 もう一つの例として、クローディンー11が挙げられる。 このクローディンは、ノザンブロットでは主に脳と精巣に発現している。 やはり特異抗体を作製して調べたところ、脳ではミエリンの細胞膜間の特殊なTJを、精巣ではセルトリ細胞間のよく発達したTJを構成していることが分かった18)。 すなわち、このクローディンは、有髄神経における跳躍伝導や、精巣における血管精巣バリアーにとって重要な分子であることが示唆された。
今のところ、他の種類のクローディンの発現は血管内皮細胞には見られていないので、クローディン-5が血管の透過性を規定する重要な分子である可能性が高い。 もう一つの例として、クローディンー11が挙げられる。 このクローディンは、ノザンブロットでは主に脳と精巣に発現している。 やはり特異抗体を作製して調べたところ、脳ではミエリンの細胞膜間の特殊なTJを、精巣ではセルトリ細胞間のよく発達したTJを構成していることが分かった18)。 すなわち、このクローディンは、有髄神経における跳躍伝導や、精巣における血管精巣バリアーにとって重要な分子であることが示唆された。 まず、それぞれのストランドが同一のクローディンからなるホモポリマーであるケースと、2種類のクローディンが共重合して(ヘテロポリマー)一本のストランドを形成しているケースが考えられる。 さらに、向かい合うストランドどうしが対合する際、同じクローディンどうしが接着するケース(ホモフィリックな接着)と、異なるクローディンどうしも接着できるケース(ヘテロフィリックな接着)が考えられる。 これらをまとめると、単純にはAからDまでの4種類のモデルが考えられる。 実際のTJでは、どのモデルが当てはまるのであろうか?
まず、それぞれのストランドが同一のクローディンからなるホモポリマーであるケースと、2種類のクローディンが共重合して(ヘテロポリマー)一本のストランドを形成しているケースが考えられる。 さらに、向かい合うストランドどうしが対合する際、同じクローディンどうしが接着するケース(ホモフィリックな接着)と、異なるクローディンどうしも接着できるケース(ヘテロフィリックな接着)が考えられる。 これらをまとめると、単純にはAからDまでの4種類のモデルが考えられる。 実際のTJでは、どのモデルが当てはまるのであろうか? MDCK細胞には、おもに、クローディン-1と-4が発現していたが、 C-CPEはクローディン-1には結合せず、クローディン-4にだけに結合することが確認された。
興味深いことに、MDCK細胞をC-CPE存在下で培養すると、 1時間以内にそのTJからクローディン-4のみが選択的に消え始め、4時間位でクローディン-1のみからなるTJに変化した。 これに平行して、電気抵抗として測定されるバリアー機能は極端に低下した。 この時、TJストランドは、
C-CPEの存在下で、急速に溶けたように壊れ始め、最終的にストランドの数が半分以下に減ることが分かった(図8)。 このペプチドを洗い流すと、再びクローディン-4がTJに濃縮し始め、バリアー機能も回復した。 以上の結果は、クローディンがTJストランドを形成することにより、上皮細胞や内皮細胞シートのバリアー機能を直接担っていることを初めて示したものである。
MDCK細胞には、おもに、クローディン-1と-4が発現していたが、 C-CPEはクローディン-1には結合せず、クローディン-4にだけに結合することが確認された。
興味深いことに、MDCK細胞をC-CPE存在下で培養すると、 1時間以内にそのTJからクローディン-4のみが選択的に消え始め、4時間位でクローディン-1のみからなるTJに変化した。 これに平行して、電気抵抗として測定されるバリアー機能は極端に低下した。 この時、TJストランドは、
C-CPEの存在下で、急速に溶けたように壊れ始め、最終的にストランドの数が半分以下に減ることが分かった(図8)。 このペプチドを洗い流すと、再びクローディン-4がTJに濃縮し始め、バリアー機能も回復した。 以上の結果は、クローディンがTJストランドを形成することにより、上皮細胞や内皮細胞シートのバリアー機能を直接担っていることを初めて示したものである。 前者ではクローディンー1とー3のヘテロポリマーが対合するので、クローディンー1どうしおよびクローディンー3どうしのホモフィリックな接着と、クローディンー1とクローディンー3のヘテロフィリックな接着が混在するが、いずれも比較的強く接着する。 しかし、後者では、クローディンー1どうしおよびクローディンー2どうしのホモフィリックな接着は強いが、強制的に向かい合わされたクローディンー1とクローディンー2は強くは接着できない。 したがって、前者のTJの方が後者より強いバリアー機能を示すことが期待できる。 ぞれぞれ単独でもTJストランドを形成できる15種類ものクローディンが存在する意味は、このようなところにあるのではないだろうか? そのTJに含まれるクローディンの種類と混合の割合によって、対合するTJストランド間に作る“穴”の数と性質を変えて、TJのバリアー機能を巧みに調節しているのではないだろうか?
前者ではクローディンー1とー3のヘテロポリマーが対合するので、クローディンー1どうしおよびクローディンー3どうしのホモフィリックな接着と、クローディンー1とクローディンー3のヘテロフィリックな接着が混在するが、いずれも比較的強く接着する。 しかし、後者では、クローディンー1どうしおよびクローディンー2どうしのホモフィリックな接着は強いが、強制的に向かい合わされたクローディンー1とクローディンー2は強くは接着できない。 したがって、前者のTJの方が後者より強いバリアー機能を示すことが期待できる。 ぞれぞれ単独でもTJストランドを形成できる15種類ものクローディンが存在する意味は、このようなところにあるのではないだろうか? そのTJに含まれるクローディンの種類と混合の割合によって、対合するTJストランド間に作る“穴”の数と性質を変えて、TJのバリアー機能を巧みに調節しているのではないだろうか? The molecular machinery involved in transport through the
transcellular pathway, i.e. channels, pumps, transporters etc.,
have been identified and well characterized in molecular terms.
In sharp contrast, our knowledge regarding paracellular transport
is limited mainly due to the lack of information on the molecular
architecture of TJs. However, recent identification of TJ-specific
integral membrane proteins prompted us to consider the molecular
mechanism behind the barrier of TJs as well as transport across
TJs.
The molecular machinery involved in transport through the
transcellular pathway, i.e. channels, pumps, transporters etc.,
have been identified and well characterized in molecular terms.
In sharp contrast, our knowledge regarding paracellular transport
is limited mainly due to the lack of information on the molecular
architecture of TJs. However, recent identification of TJ-specific
integral membrane proteins prompted us to consider the molecular
mechanism behind the barrier of TJs as well as transport across
TJs. These proteins, named claudin-1 and -2, were structurally
related (~30% identical at the amino acid sequence level) but
showed no sequence similarity to occludin. The most characteristic
feature of these molecules was that they reconstituted TJs in
fibroblasts when singly transfected (Furuse et al., 1998b). The
reconstituted TJs were morphologically indistinguishable from
those in situ, although they were not zonula but
puncta occludens; ultrathin and freeze-fracture replica
electron microscopy identified the formation of kissing points
and paired strands, respectively, between adjacent transfectants
(Kubota et al., 1999; Furuse et al., 1998b).
These proteins, named claudin-1 and -2, were structurally
related (~30% identical at the amino acid sequence level) but
showed no sequence similarity to occludin. The most characteristic
feature of these molecules was that they reconstituted TJs in
fibroblasts when singly transfected (Furuse et al., 1998b). The
reconstituted TJs were morphologically indistinguishable from
those in situ, although they were not zonula but
puncta occludens; ultrathin and freeze-fracture replica
electron microscopy identified the formation of kissing points
and paired strands, respectively, between adjacent transfectants
(Kubota et al., 1999; Furuse et al., 1998b). [3] When L transfectants singly expressing claudin-1 were
[3] When L transfectants singly expressing claudin-1 were
