 園田さんは九州大学の医学部を卒業し、内科で糖尿病の専門医として2年間研修しました。 その後、大学へ戻って大学院で研究をする時期になりましたが、名和田教授の推薦で京大の私たちの研究室に大学院生として受験し、本格的な研究活動を開始することになりました。 ごらんの通り、そして、バスケットにプロという、ナイスガイ。 でも、ちゃんと京都へ来る前に、整形外科医の奥さんをゲットしています。 大学院に入って2年目でこの論文を仕上げました。 クローディンの機能解析としては初の論文です。
園田さんは九州大学の医学部を卒業し、内科で糖尿病の専門医として2年間研修しました。 その後、大学へ戻って大学院で研究をする時期になりましたが、名和田教授の推薦で京大の私たちの研究室に大学院生として受験し、本格的な研究活動を開始することになりました。 ごらんの通り、そして、バスケットにプロという、ナイスガイ。 でも、ちゃんと京都へ来る前に、整形外科医の奥さんをゲットしています。 大学院に入って2年目でこの論文を仕上げました。 クローディンの機能解析としては初の論文です。Sonoda,N., Furuse,M., Sasaki,H., Yonemura,S., Katahira,J., Horiguchi,Y., and Tsukita,Sh.
J.Cell Biol. 147,195-2041 (1999)
【筆頭著者紹介】
 園田さんは九州大学の医学部を卒業し、内科で糖尿病の専門医として2年間研修しました。 その後、大学へ戻って大学院で研究をする時期になりましたが、名和田教授の推薦で京大の私たちの研究室に大学院生として受験し、本格的な研究活動を開始することになりました。 ごらんの通り、そして、バスケットにプロという、ナイスガイ。 でも、ちゃんと京都へ来る前に、整形外科医の奥さんをゲットしています。 大学院に入って2年目でこの論文を仕上げました。 クローディンの機能解析としては初の論文です。
園田さんは九州大学の医学部を卒業し、内科で糖尿病の専門医として2年間研修しました。 その後、大学へ戻って大学院で研究をする時期になりましたが、名和田教授の推薦で京大の私たちの研究室に大学院生として受験し、本格的な研究活動を開始することになりました。 ごらんの通り、そして、バスケットにプロという、ナイスガイ。 でも、ちゃんと京都へ来る前に、整形外科医の奥さんをゲットしています。 大学院に入って2年目でこの論文を仕上げました。 クローディンの機能解析としては初の論文です。
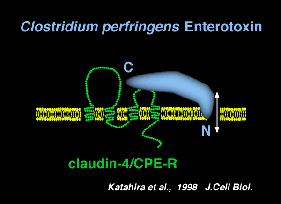 Clostridium perfringensという最近はペプチド性の腸内毒素(CPE)を分泌し、軽い食中毒を起こす。 阪大微研の片平らは、この毒素の細胞側のレセプターを同定し、CPEレセプター(CPE−R)と報告していた。 我々がクローディンー1,ー2を同定してみると、このCPE−Rに似ていることが分かり、CPE−Rをクローディンー4と呼ぶようになった。 すなわち、この毒素はクローディンー4をレセプターとして利用していたことになる。 この毒素は、そのC末端半分でクローディンー4(CPEーR)に結合し、N末端半分で細胞膜に穴をあけることが分かっていた。 そこで、この毒素のC末端半分のペプチド(C−CPE)は、クローディンー4に特異的に結合するペプチドとして利用できるのではないかと考えるようになった。
Clostridium perfringensという最近はペプチド性の腸内毒素(CPE)を分泌し、軽い食中毒を起こす。 阪大微研の片平らは、この毒素の細胞側のレセプターを同定し、CPEレセプター(CPE−R)と報告していた。 我々がクローディンー1,ー2を同定してみると、このCPE−Rに似ていることが分かり、CPE−Rをクローディンー4と呼ぶようになった。 すなわち、この毒素はクローディンー4をレセプターとして利用していたことになる。 この毒素は、そのC末端半分でクローディンー4(CPEーR)に結合し、N末端半分で細胞膜に穴をあけることが分かっていた。 そこで、この毒素のC末端半分のペプチド(C−CPE)は、クローディンー4に特異的に結合するペプチドとして利用できるのではないかと考えるようになった。
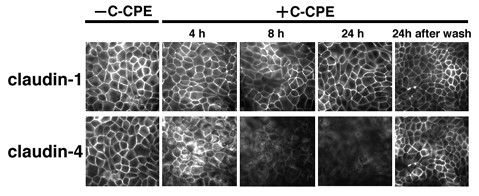
都合の良いことに、上図のように、培養MDCK上皮細胞は、主にクローディンー1とー4を発現している。 そこで、この細胞をC−CPE存在下で培養してみた。 すると、かなり早い時間経過でタイトジャンククションから、クローディンー4だけが消失し、クローディンー1だけが残ることが分かった。 このC−CPEを洗い流すとクローディンー4はタイトジャンクションに戻ってくる。
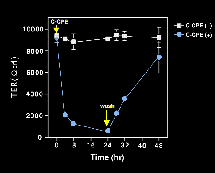 この過程で上皮細胞のバリアー機能がどう変わるかをTERを計ることにより測定したのが左図である。 クローディンー4の消失の時間経過に一致してバリアー機能が極端に低下することが分かった。
この過程で上皮細胞のバリアー機能がどう変わるかをTERを計ることにより測定したのが左図である。 クローディンー4の消失の時間経過に一致してバリアー機能が極端に低下することが分かった。
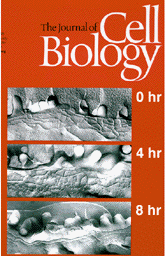 この時タイトジャンクションの構造はどうなっているであろうか。 左図のように、バリアー機能が失われるのと同時に、タイトジャンクションのストランドが溶け始め、最終的にはきわめて貧弱なネットワークに変化することが分かった。
この時タイトジャンクションの構造はどうなっているであろうか。 左図のように、バリアー機能が失われるのと同時に、タイトジャンクションのストランドが溶け始め、最終的にはきわめて貧弱なネットワークに変化することが分かった。
以上の結果は、タイトジャンクションストランドのクローディンによる形成が、上皮細胞のバリアー機能そのものを担っていることをはじめて実験的に示したものであり、左のようにJCBの表紙を飾ることになった。
![]()