Transglutaminase type 1 and its cross-linking activity are
concentrated at adherens junctions in simple epithelial cells.
Hiiragi,T., Sasaki,H., Nagafuchi,A., Sabe,H., Shen,S.C., Matsu
ki,M., Yamanishi,K., and Tsukita,Sh.
J.Biol.Chem. 274, 34148-34154 (1999)
【筆頭著者紹介】
 柊さんは、月田研が京都へ移ってきた時の第一期生の大学院生です。 京大医学部を出てから、将来基礎研究をするためには、臨床も経験しておくべきだという信念のもとに、神戸市民病院で2年間の研修を終え、ちょうど京大へ我々が移ってきた時に我々の研究室に参加しました。 研究に関して、信念の人で、最初から独自の研究分野を開発することに執念を燃やしていました。 我々の単離ジャンクション分画でチロシンリン酸かされている蛋白質の検索を続けていくうちに、transglutaminase
type 1というおもしろい酵素に遭遇し、その発展としてこの仕事をJBCに発表しました。 彼のようなタイプの学生は最近とても珍しいのですが、その雰囲気から「オヤジ」と命名しました。 本物の研究を目指して、オヤジには頑張って欲しいものです。 これから、ごく最近結婚された音楽家の奥様とともに、ドイツで新しい分野に挑戦するそうです。
柊さんは、月田研が京都へ移ってきた時の第一期生の大学院生です。 京大医学部を出てから、将来基礎研究をするためには、臨床も経験しておくべきだという信念のもとに、神戸市民病院で2年間の研修を終え、ちょうど京大へ我々が移ってきた時に我々の研究室に参加しました。 研究に関して、信念の人で、最初から独自の研究分野を開発することに執念を燃やしていました。 我々の単離ジャンクション分画でチロシンリン酸かされている蛋白質の検索を続けていくうちに、transglutaminase
type 1というおもしろい酵素に遭遇し、その発展としてこの仕事をJBCに発表しました。 彼のようなタイプの学生は最近とても珍しいのですが、その雰囲気から「オヤジ」と命名しました。 本物の研究を目指して、オヤジには頑張って欲しいものです。 これから、ごく最近結婚された音楽家の奥様とともに、ドイツで新しい分野に挑戦するそうです。
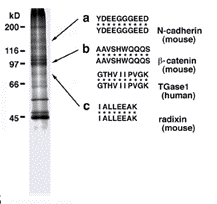 我々の研究室では従来から単離ジャンクション分画を用いて解析を進めて来ました。 この仕事では、まず、単離分画でチロシンりん酸化される蛋白質の検索を行いました。 その結果、抗リン酸化チロシン抗体で見えるように(左図)、いくつかのバンドが強く燐酸化されることが分かりました。 これらの蛋白質をこの分画から抗リン酸化チロシン抗体カラムで回収し、そのアミノ酸配列を決めました。 その結果、カドヘリンやカテニン、ラディキシンといった従来から研究が進んでいるものの他に、トランスグルタミニネース1型(TGase1)が同定されました。 TGase1はこれまで表皮細胞にのみ発現していて、ケラチンなどを直接共有結合で架橋し、角化層の形成に重要な役割を果たしていると考えられていたものです。 どうしてこのような酵素がジャンクションフラクションに濃縮しているのでしょう?
我々の研究室では従来から単離ジャンクション分画を用いて解析を進めて来ました。 この仕事では、まず、単離分画でチロシンりん酸化される蛋白質の検索を行いました。 その結果、抗リン酸化チロシン抗体で見えるように(左図)、いくつかのバンドが強く燐酸化されることが分かりました。 これらの蛋白質をこの分画から抗リン酸化チロシン抗体カラムで回収し、そのアミノ酸配列を決めました。 その結果、カドヘリンやカテニン、ラディキシンといった従来から研究が進んでいるものの他に、トランスグルタミニネース1型(TGase1)が同定されました。 TGase1はこれまで表皮細胞にのみ発現していて、ケラチンなどを直接共有結合で架橋し、角化層の形成に重要な役割を果たしていると考えられていたものです。 どうしてこのような酵素がジャンクションフラクションに濃縮しているのでしょう?
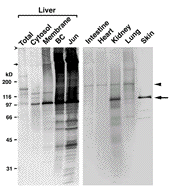 そもそもTGase1に対する良い抗体がないことが分かったので、マウスのTGase1cDNAを単離し、リコンビナント蛋白質を作り、特異的なポリクローナル抗体とモノクローナル抗体を作製することに成功しました。 その抗体で単離分画をウェスタンしてみると、左図のように、TGase1そのものが97kDのバンドとして分画に濃縮しているだけでなく、いろいろな蛋白質に自分自身も架橋されて分画に濃縮していることが分かりました。 もちろん、皮膚にも多く発現していました。
そもそもTGase1に対する良い抗体がないことが分かったので、マウスのTGase1cDNAを単離し、リコンビナント蛋白質を作り、特異的なポリクローナル抗体とモノクローナル抗体を作製することに成功しました。 その抗体で単離分画をウェスタンしてみると、左図のように、TGase1そのものが97kDのバンドとして分画に濃縮しているだけでなく、いろいろな蛋白質に自分自身も架橋されて分画に濃縮していることが分かりました。 もちろん、皮膚にも多く発現していました。
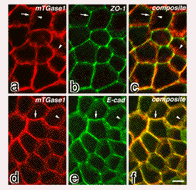
この抗体を用いて詳細な解析を行いましたが、ここでは一つだけ示します。 下の図は培養上皮細胞におけるTGase1の分布を示したものです。 この酵素自身がアドヘレンスジャンクションに濃縮していることが分かります。 この酵素の活性もアドヘレンスジャンクションに濃縮していました。
 以上のような解析から、TGase1がアドヘレンスジャンクションの裏打ちで、いろいろな蛋白質を架橋して安定化しているのではないかと考えるようになりました。 これまで、このような共有結合が利用されていることは、あまり考えられてこなかっただけに、この成果は細胞間接着の制御を考える上で、あたらしい機構を提唱しています。
以上のような解析から、TGase1がアドヘレンスジャンクションの裏打ちで、いろいろな蛋白質を架橋して安定化しているのではないかと考えるようになりました。 これまで、このような共有結合が利用されていることは、あまり考えられてこなかっただけに、この成果は細胞間接着の制御を考える上で、あたらしい機構を提唱しています。

 柊さんは、月田研が京都へ移ってきた時の第一期生の大学院生です。 京大医学部を出てから、将来基礎研究をするためには、臨床も経験しておくべきだという信念のもとに、神戸市民病院で2年間の研修を終え、ちょうど京大へ我々が移ってきた時に我々の研究室に参加しました。 研究に関して、信念の人で、最初から独自の研究分野を開発することに執念を燃やしていました。 我々の単離ジャンクション分画でチロシンリン酸かされている蛋白質の検索を続けていくうちに、transglutaminase
type 1というおもしろい酵素に遭遇し、その発展としてこの仕事をJBCに発表しました。 彼のようなタイプの学生は最近とても珍しいのですが、その雰囲気から「オヤジ」と命名しました。 本物の研究を目指して、オヤジには頑張って欲しいものです。 これから、ごく最近結婚された音楽家の奥様とともに、ドイツで新しい分野に挑戦するそうです。
柊さんは、月田研が京都へ移ってきた時の第一期生の大学院生です。 京大医学部を出てから、将来基礎研究をするためには、臨床も経験しておくべきだという信念のもとに、神戸市民病院で2年間の研修を終え、ちょうど京大へ我々が移ってきた時に我々の研究室に参加しました。 研究に関して、信念の人で、最初から独自の研究分野を開発することに執念を燃やしていました。 我々の単離ジャンクション分画でチロシンリン酸かされている蛋白質の検索を続けていくうちに、transglutaminase
type 1というおもしろい酵素に遭遇し、その発展としてこの仕事をJBCに発表しました。 彼のようなタイプの学生は最近とても珍しいのですが、その雰囲気から「オヤジ」と命名しました。 本物の研究を目指して、オヤジには頑張って欲しいものです。 これから、ごく最近結婚された音楽家の奥様とともに、ドイツで新しい分野に挑戦するそうです。

