 例えば、細胞質分裂の時に、細胞の赤道面の細胞膜直下にアクチンフィラメントが集まり、細胞膜を内側へ引き込むことにより分裂溝ができるのは有名です。 しかし、アクチンフィラメントと細胞膜がどのような分子機構で結合しているかは、謎のままでした。
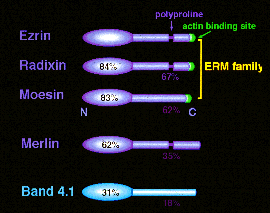
例えば、細胞質分裂の時に、細胞の赤道面の細胞膜直下にアクチンフィラメントが集まり、細胞膜を内側へ引き込むことにより分裂溝ができるのは有名です。 しかし、アクチンフィラメントと細胞膜がどのような分子機構で結合しているかは、謎のままでした。我々が得た分画にはアドヘレンスジャンクションが濃縮していました。 ということは、アクチンフィラメントと細胞膜を結合させる蛋白質もこの分画に濃縮している筈です。 その候補として分子量82kdのアクチン結合蛋白質をこの分画から精製し、ラディキシン(Radixin)と名付けました。 cDNAクローニングをしたところ、エズリン(Ezrin)と呼ばれる小腸の微絨毛から同定された裏打ち蛋白質と、モエシン(Moesin)と呼ばれるあまり性質のよく分かっていなかった蛋白質ときわめてよく似ていることが分かりました。 そこで、右上図に示すように、それぞれの頭文字をとって、この遺伝子群にERMファミリーと名付けました。
 また、このERMファミリーは、バンド4.1スーパーファミリ−に含まれることも分かりました。
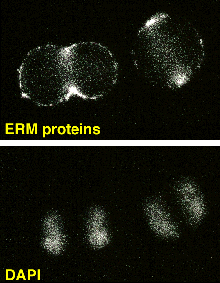
また、このERMファミリーは、バンド4.1スーパーファミリ−に含まれることも分かりました。さて、このERM蛋白質は、培養細胞では、3つとも共発現していて、微絨毛、ラッフリング膜、細胞間と細胞基質間接着部位、さらには左図に示すように分裂細胞の分裂溝に濃縮しています。このことは、ERM蛋白質が細胞膜とアクチンフィラメントの結合に一般的に重要な役割をしていることを強く示唆していました。 それぞれの発現をアンチセンスオリゴで抑えてやると、微絨毛がなくなったり、接着が壊れたりしました。 また、これらの分子はアミノ末端でCD44と呼ばれる膜蛋白質に直接結合することを見つけました。 他のグループがカルボキシル末端でアクチンフィラメントに結合することを示していましたので、ERM蛋白質が細胞膜とアクチンフィラメントの架橋蛋白質として働くことが明らかになりました。
このあたりまでは、ERM蛋白質の研究は、我々も含め数グループが進めている静かな分野でしたが、遺伝性にシュワン細胞の腫瘍が多発する病気である神経線維腫症2型(NF2)のがん抑制遺伝子が同定され、その産物がERM蛋白質ときわめてよく似ていることが分かり(Merlin: Moesin-Ezrin-Radixin-like protein)、一躍脚光を浴びる結果となりました。
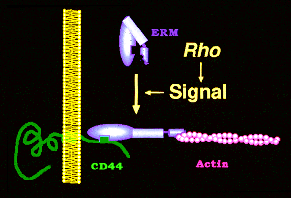 さらに、右下図に示すように、我々が細胞膜とERM蛋白質の結合が低分子量GTP結合蛋白質Rhoによって制御されていることを大阪大学の高井研究室とともに示し、それがRhoを研究していた他のグループによっても確認される事態に至って、ERM蛋白質を研究するグループは急速に増えつつあります。 さらに、我々は、ERM蛋白質の架橋蛋白質としての活性化状態が燐酸化によって制御されていることを見出し、アクチンフィラメントとシグナル伝達とのインターフェースとしてのERM蛋白質の解析を続けています。
さらに、右下図に示すように、我々が細胞膜とERM蛋白質の結合が低分子量GTP結合蛋白質Rhoによって制御されていることを大阪大学の高井研究室とともに示し、それがRhoを研究していた他のグループによっても確認される事態に至って、ERM蛋白質を研究するグループは急速に増えつつあります。 さらに、我々は、ERM蛋白質の架橋蛋白質としての活性化状態が燐酸化によって制御されていることを見出し、アクチンフィラメントとシグナル伝達とのインターフェースとしてのERM蛋白質の解析を続けています。