カテニン研究
カドヘリンが形態形成に最も重要な細胞間接着分子であることを疑う人はいないでしょう。 このカドヘリンの機能調節やシグナル伝達に関与する細胞質側の因子が解析され、カドヘリンの細胞質ドメインに直接結合する蛋白質が少なくとも2種類あることが知られていました。 一つは分子量102kD、もう一つは94kDで、それぞれαカテニン、βカテニンと呼ばれていましたが、私たちが細胞間接着装置を単離したころには、それらの詳細は不明でした。 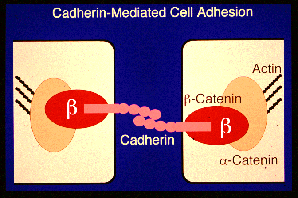 アドヘレンスジャンクションにカドヘリンが濃縮しているのなら、これらの分子も濃縮しているであろうという仮定のもとに、我々の分画からカテニン、特に、αカテニンを精製し、その遺伝子を単離することに初めて成功し、ビンキュリンという、やはり接着部位の細胞質側に濃縮する蛋白質に似ていることが分かりました。 また、同じ年の終わりに、アメリカのグループによって、βカテニンの遺伝子が単離され、アルマジロ遺伝子と呼ばれるショウジョウバエの形態形成遺伝子の産物に似ていることが分かりました。 これが、現在、きわめて注目されているカテニンの分子生物学の幕開けでした。 現在では、右図に示すように、カドヘリンの細胞質ドメインにβカテニンが結合し、それにαカテニ
アドヘレンスジャンクションにカドヘリンが濃縮しているのなら、これらの分子も濃縮しているであろうという仮定のもとに、我々の分画からカテニン、特に、αカテニンを精製し、その遺伝子を単離することに初めて成功し、ビンキュリンという、やはり接着部位の細胞質側に濃縮する蛋白質に似ていることが分かりました。 また、同じ年の終わりに、アメリカのグループによって、βカテニンの遺伝子が単離され、アルマジロ遺伝子と呼ばれるショウジョウバエの形態形成遺伝子の産物に似ていることが分かりました。 これが、現在、きわめて注目されているカテニンの分子生物学の幕開けでした。 現在では、右図に示すように、カドヘリンの細胞質ドメインにβカテニンが結合し、それにαカテニ ンが結合していること、さらに、APCと呼ばれるがん抑制遺伝子産物がβカテニンが結合して、βカテニンの分解を制御していることが明らかになっています。 カテニン系は細胞間接着のレギュレーターとして働くだけでなく、核へ移行して重要なシグナル伝達物質としても働いている訳で、現在この分野はさらに発展しつつあります。
ンが結合していること、さらに、APCと呼ばれるがん抑制遺伝子産物がβカテニンが結合して、βカテニンの分解を制御していることが明らかになっています。 カテニン系は細胞間接着のレギュレーターとして働くだけでなく、核へ移行して重要なシグナル伝達物質としても働いている訳で、現在この分野はさらに発展しつつあります。
左図には、当時、得られた遺伝子からリコンビナントのαカテニン蛋白質を作り、それを抗原にして初めてヒトαカテニンを染めれるモノクローナル抗体を得て、それで染めた細胞の像を示します。その後、この研究室では、αカテニンがある種の胃ガン(硬がん)でその発現が無くなっていることを、国立がんセンターの広橋説雄博士の研究室と共同で見出し、がん化とカテニンの関係についてはじめて明らかにしました。 また、当時、我々の研究室で講師をしていた、永渕昭良博士は、αカテニンとカドヘリンの融合蛋白質を作るという変わった方法で、βカテニンの機能に迫りました。 永渕博士は、最近、私たちの研究室から熊本大学発生センター教授として独立し、カテニンの研究を続けています。

 アドヘレンスジャンクションにカドヘリンが濃縮しているのなら、これらの分子も濃縮しているであろうという仮定のもとに、我々の分画からカテニン、特に、αカテニンを精製し、その遺伝子を単離することに初めて成功し、ビンキュリンという、やはり接着部位の細胞質側に濃縮する蛋白質に似ていることが分かりました。 また、同じ年の終わりに、アメリカのグループによって、βカテニンの遺伝子が単離され、アルマジロ遺伝子と呼ばれるショウジョウバエの形態形成遺伝子の産物に似ていることが分かりました。 これが、現在、きわめて注目されているカテニンの分子生物学の幕開けでした。 現在では、右図に示すように、カドヘリンの細胞質ドメインにβカテニンが結合し、それにαカテニ
アドヘレンスジャンクションにカドヘリンが濃縮しているのなら、これらの分子も濃縮しているであろうという仮定のもとに、我々の分画からカテニン、特に、αカテニンを精製し、その遺伝子を単離することに初めて成功し、ビンキュリンという、やはり接着部位の細胞質側に濃縮する蛋白質に似ていることが分かりました。 また、同じ年の終わりに、アメリカのグループによって、βカテニンの遺伝子が単離され、アルマジロ遺伝子と呼ばれるショウジョウバエの形態形成遺伝子の産物に似ていることが分かりました。 これが、現在、きわめて注目されているカテニンの分子生物学の幕開けでした。 現在では、右図に示すように、カドヘリンの細胞質ドメインにβカテニンが結合し、それにαカテニ ンが結合していること、さらに、APCと呼ばれるがん抑制遺伝子産物がβカテニンが結合して、βカテニンの分解を制御していることが明らかになっています。 カテニン系は細胞間接着のレギュレーターとして働くだけでなく、核へ移行して重要なシグナル伝達物質としても働いている訳で、現在この分野はさらに発展しつつあります。
ンが結合していること、さらに、APCと呼ばれるがん抑制遺伝子産物がβカテニンが結合して、βカテニンの分解を制御していることが明らかになっています。 カテニン系は細胞間接着のレギュレーターとして働くだけでなく、核へ移行して重要なシグナル伝達物質としても働いている訳で、現在この分野はさらに発展しつつあります。