厽丏偼偠傔偵
丂巹偼堛妛晹傪懖嬈偟傑偟偰偐傜丄搶嫗戝妛堛妛晹偺夝朥妛嫵幒偱弮悎側宍懺妛偵傕偲偯偄偨嵶朎惗暔妛傪曌嫮偟丄偦偺屻丄搶嫗搒椪彴堛妛憤崌尋媶強偱惗壔妛揑尋媶傪奐巒偟丄壀嶈偵偁傝傑偡崙棫惗棟妛尋媶強偱屄懱傪摑崌揑僔僗僥儉偲偟偰懆偊傞惗棟妛傪曌嫮偟傑偟偨丅偦偟偰丄尰嵼偼丄揱摑偁傞暘巕惗暔妛偺島嵗偱偁傞嫗搒戝妛戝妛堾堛妛尋媶壢暘巕嵶朎忣曬妛乮媽堛壔妛戞擇島嵗乯偱尋媶傪偟偰偍傝傑偡丅
丂傛偔丄変乆偺暘巕惗暔妛揑尋媶偼儐僯乕僋偩偲丄弮悎側暘巕惗暔妛偺尋媶幰偐傜尵偭偰偄偨偩偒傑偡丅尵偄姺偊傟偽丄乽曄傢偭偰偄傞乿丄偲偄偆偙偲偵側傞偺偐傕偟傟傑偣傫丅偦偺尨場偼丄夝朥妛丒惗壔妛丒惗棟妛偲搉傝曕偄偰偒偨巹帺恎偺宱楌偵傛傞傕偺偐傕偟傟傑偣傫丅惗暔偺偁傞尰徾偵嫽枴傪傕偪丄曄堎懱偺暘棧傗峈懱傗栻暔偵傛傞婡擻慾奞偲偄偭偨庤朄傪梡偄偰偦偺尰徾傪扴偆堚揱巕傪摨掕偡傞偲偄偆丄暘巕惗暔妛偺杮摴偲偼堎側傝丄巹偨偪偺尋媶偺僗僞乕僩偵偼丄忢偵乽宍懺乿偑偁傝傑偡丅乽宍偁傞傕偺偵偼婡擻偑偁傞乿偲偄偆慜採偺傕偲偵丄偁傞乽宍乿丄偨偲偊偽丄偁傞婡擻偑憐掕偝傟偰偄傞嵶朎撪偺峔憿偵嫽枴傪傕偪丄偦偺峔憿傪峔惉偟偰偄傞抈敀幙傪暘棧偟丄偦偺堚揱巕傪扨棧偟丄偦偟偰嵟屻偵丄偦偺堚揱巕傪棙梡偟偰嵟弶偵憐掕偟偨婡擻偵娭偡傞暘巕惗暔妛揑夝愅傪峴偆偲偄偆傗傝曽偱偡丅偙偺傛偆側曽岦偺尋媶偼丄巹偨偪偑尋媶傪巒傔偨偙傠丄偡側傢偪俹俠俼傕幙検暘愅偵傛傞傾儈僲巁攝楍偺寛掕傕偱偒側偐偭偨偙傠偵偼丄懡偔偺媄弍揑側崲擄傪敽偄傑偟偨丅偟偐偟丄僸僩傗儅僂僗偺慡僎僲儉偑寛掕偝傟偨崱丄偦偺媄弍揑崲擄偝偼傎傏偡傋偰夝徚偟偰偟傑偭偰偄傞傛偆偵巚偄傑偡丅媡偵尵偆偲丄巹偨偪偑恑傔偰偒偨尋媶庤朄偼丄偄傑棳峴傝偺乽僾儘僥僆乕儉夝愅乿偺愭嬱偗偩偭偨偺偐傕偟傟傑偣傫丅
丂杮擔偼丄僶儕傾乕偲偄偆婡擻傪扴偆偱偁傠偆偲悇掕偝傟偰偄偨僞僀僩僕儍儞僋僔儑儞偲偄偆峔憿偵拲栚偟偨偲偙傠偐傜巒傑偭偨変乆偺尋媶偵偮偄偰丄徟揰傪峣偭偰偍榖偟偨偄偲巚偄傑偡丅
厾丏僞僀僩僕儍儞僋僔儑儞偵憐掕偝傟偰偄偨僶儕傾乕婡擻
丂懡嵶朎惗暔偼丄懡偔偺嵶朎偑偍屳偄偵婡夿揑偵寢傃偮偗傜傟傞乮愙拝偡傞乯偙偲偵傛偭偰宍嶌傜傟偰偄傑偡偑丄偙傟傜偲偼慡偔暿偺娤揰偐傜丄嵶朎娫偺愙拝偑懡嵶朎惗暔偵偲偭偰杮幙揑偵廳梫偱偁傞偙偲偑屆偔偐傜抦傜傟偰偄傑偡丅偦傟偼丄乽嵶朎娫傪捠偭偨暔幙偺堏摦乮楻傟乯偺惂屼乿偲偄偆娤揰偱偡丅
 丂
丂
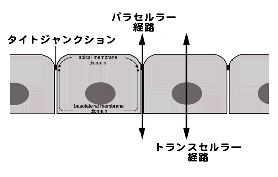
丂懡嵶朎惗暔偼忋旂嵶朎偵埻傑傟傞偙偲偵傛傝丄傑偢帺屓偺撪偲奜偵嬫暿偝傟偰偄傑偡丅偦偟偰丄懱偺拞偼丄忋旂嵶朎傗撪旂嵶朎偺僔乕僩偵傛傝丄偝傜偵偄偔偮傕偺僐儞僷乕僩儊儞僩偵暘偗傜傟偰偄傑偡丅僐儞僷乕僩儊儞僩偺拞偺僀僆儞娐嫬傗抈敀幙偺庬椶丒擹搙側偳偼丄偦傟偧傟偺婡擻偵墳偠偰戝偒偔堎側偭偰偄偰丄偙偺娐嫬傪摦揑偵曐偮偙偲偑丄懡嵶朎惗暔偑惗偒偰偄偔忋偱昁梫晄壜寚偱偁傞偙偲偼傛偔抦傜傟偰偄傑偡丅偟偐偟丄懡嵶朎惗暔偱偁傞偑屘偵丄偙傟傜偺僐儞僷乕僩儊儞僩傪巇愗傞暻偼嵶朎傪暲傋偰嶌傜偞傞傪摼側偄栿偱丄偄偔傜僇僪僿儕儞側偳偺嫮椡側愙拝暘巕偱嵶朎娫傪寢崌偝偣偰傕丄悈丒僀僆儞丒抈敀幙側偳偼嵶朎娫傪帺桼偵捠偭偰偟傑偄傑偡丅偦偙偱丄懡嵶朎惗暔偑懚嵼偡傞偨傔偵偼丄偙偺嵶朎娫傪捠偭偨暔幙偺堏摦乮楻傟乯傪杊偖偨傔偺摿庩側愙拝婡峔偑昁梫偲側傝傑偡丅偦傟偑僞僀僩僕儍儞僋僔儑儞乮埲壓俿俰乯偲屇偽傟傞愙拝憰抲偱丄偙偙偱偼椬傝崌偆嵶朎娫偺嵶朎枌偺嫍棧偑僛儘偵傑偱嬤偯偄偰偄偰丄嵶朎娫傪捠偭偨暔幙偺堏摦傪杊偄偱偄傞偲峫偊傜傟偰偒傑偟偨乮恾侾乯丅
丂愐捙摦暔偱偼丄偙偺俿俰傪忋旂嵶朎娫傗撪旂嵶朎娫偵敪払偝偣傞偙偲偵傛傝丄偙傟傜偺嵶朎僔乕僩偑奺僐儞僷乕僩儊儞僩偺娐嫬傪庣傞僶儕傾乕偲偟偰摥偔偙偲傪壜擻偲偟偰偄傞偺偱偡丅偟偐偟丄俿俰偺暘巕揑婎斦偵娭偡傞変乆偺抦幆偑偒傢傔偰枹弉偱偁偭偨偨傔偵丄偙偺懡嵶朎惗暔偵偲偭偰偒傢傔偰婎杮揑側乽僶儕傾乕乿偲偄偆栤戣偵娭偟偰偼丄傑偭偨偔暘巕惗暔妛揑庤朄偵傛傞夝愅偑側偝傟偰偄側偄忬懺偱偟偨丅
叀丏僞僀僩僕儍儞僋僔儑儞偲屇偽傟傞峔憿
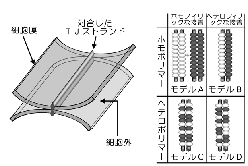
丂扨憌偺忋旂嵶朎偱偼丄椬傝崌偆嵶朎枌乮儔僥儔儖枌乯偺傕偭偲傕傾僺僇儖傛傝偵俿俰偲屇偽傟傞嵶朎娫愙拝椞堟偑偁傝丄偦傟偧傟偺嵶朎傪庢傝姫偄偰偄傑偡乮恾俀乯丅
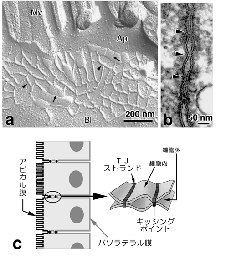 偙偺俿俰偼摿庩側愙拝憰抲偱丄挻敄愗曅憸偱尒傞偲丄偲偙傠偳偙傠偱岦偐偄崌偆嵶朎枌娫偺嫍棧偑僛儘偵傑偱嬤偯偄偰偄傑偡乮俿俰偺僉僢僔儞僌億僀儞僩偲屇偽傟傑偡乯丅傑偨丄搥寢妱抐儗僾儕僇朄偱娤嶡偡傞偲丄俿俰偺晹暘偱偼丄枌撪棻巕偑堦楍偵暲傫偩僗僩儔儞僪乮俿俰僗僩儔儞僪乯偑曇傒栚傪峔惉偟偰偄傑偡丅偙偺傛偆側娤嶡偐傜丄俿俰偺峔憿偼恾俀偺傛偆側傕偺偱偁傞偲憐憸偝傟偰偒傑偟偨丅偡側傢偪丄壗傜偐偺撪嵼惈枌抈敀幙偑嵶朎枌偺拞偱慄忬偵廳崌偟偰俿俰僗僩儔儞僪傪宍惉偟丄岦偐偄崌偆嵶朎枌拞偺俿俰僗僩儔儞僪偲懁柺偱懳崌偡傞偙偲偵傛傝僉僢僔儞僌億僀儞僩傪宍惉偡傞偲偄偆峔憿偱偡丅偟偐偟丄晄巚媍側偙偲偵丄偙偺俿俰僗僩儔儞僪傪峔惉偡傞撪嵼惈枌抈敀幙偺幚懱偼挿偄娫撲偵曪傑傟偰偍傝丄俿俰僗僩儔儞僪偑摿庩側帀幙偺媡儈僙儖偐傜弌棃偰偄傞偲偄偆帀幙愢傕桳椡帇偝傟傞傑偱偵側偭偰偄傑偟偨丅
偙偺俿俰偼摿庩側愙拝憰抲偱丄挻敄愗曅憸偱尒傞偲丄偲偙傠偳偙傠偱岦偐偄崌偆嵶朎枌娫偺嫍棧偑僛儘偵傑偱嬤偯偄偰偄傑偡乮俿俰偺僉僢僔儞僌億僀儞僩偲屇偽傟傑偡乯丅傑偨丄搥寢妱抐儗僾儕僇朄偱娤嶡偡傞偲丄俿俰偺晹暘偱偼丄枌撪棻巕偑堦楍偵暲傫偩僗僩儔儞僪乮俿俰僗僩儔儞僪乯偑曇傒栚傪峔惉偟偰偄傑偡丅偙偺傛偆側娤嶡偐傜丄俿俰偺峔憿偼恾俀偺傛偆側傕偺偱偁傞偲憐憸偝傟偰偒傑偟偨丅偡側傢偪丄壗傜偐偺撪嵼惈枌抈敀幙偑嵶朎枌偺拞偱慄忬偵廳崌偟偰俿俰僗僩儔儞僪傪宍惉偟丄岦偐偄崌偆嵶朎枌拞偺俿俰僗僩儔儞僪偲懁柺偱懳崌偡傞偙偲偵傛傝僉僢僔儞僌億僀儞僩傪宍惉偡傞偲偄偆峔憿偱偡丅偟偐偟丄晄巚媍側偙偲偵丄偙偺俿俰僗僩儔儞僪傪峔惉偡傞撪嵼惈枌抈敀幙偺幚懱偼挿偄娫撲偵曪傑傟偰偍傝丄俿俰僗僩儔儞僪偑摿庩側帀幙偺媡儈僙儖偐傜弌棃偰偄傞偲偄偆帀幙愢傕桳椡帇偝傟傞傑偱偵側偭偰偄傑偟偨丅
參丏僕儍儞僋僔儑儞偺扨棧偲僆僋儖僨傿儞偺敪尒
丂変乆偼丄傕偲傕偲丄僇僪僿儕儞偑婡擻偡傞愙拝憰抲乮傾僪僿儗儞僗僕儍儞僋僔儑儞乯偺暘巕峔抸傪柧傜偐偵偡傞偨傔偵丄傾僪僿儗儞僗僕儍儞僋僔儑儞偑擹弅偟偨暘夋傪娞憻偐傜扨棧偡傞曽朄傪奐敪偟偰偄傑偟偨偑1)丄尋媶偺夁掱偱丄偙偺暘夋偵俿俰傕嬌搙偵擹弅偟偰偄傞偙偲偵婥偯偒傑偟偨2,3)乮恾俁乯丅
傕偟丄俿俰僗僩儔儞僪偑撪嵼惈枌抈敀幙偵傛偭偰峔惉偝傟偰偄傞偺偱偁傟偽丄偦偺傛偆側抈敀幙傕偙偺暘夋偵擹弅偟偰偄傞敜偱偡丅偦偙偱偙偺僯儚僩儕偺娞憻偐傜摼偨扨棧暘夋傪峈尨偵偟偰儌僲僋儘乕僫儖峈懱傪摼傞偙偲偵傛傝丄俿俰僗僩儔儞僪傪峔惉偡傞暘巕検俇俆倠俢倎偺枌抈敀幙傪弶傔偰摨掕偡傞偙偲偵惉岟偟傑偟偨4)乮恾係乯丅偦偙偱偙偺枌抈敀幙傪僆僋儖僨傿儞乮occludin丗儔僥儞岅偺occlude丄暵偠傞偺堄丄偐傜乯偲柤晅偗丄僯儚僩儕僆僋儖僨傿儞偺們俢俶俙傪扨棧偟偨偲偙傠丄怴婯偺係夞枌娧捠宆抈敀幙偱偁傞偙偲偑柧傜偐偵側傝傑偟偨丅偙偺傛偆偵偟偰丄俿俰僗僩儔儞僪傪峔惉偡傞枌抈敀幙偲偟偰丄僯儚僩儕偺僆僋儖僨傿儞偑弶傔偰摨掕偝傟偨偺偼丄侾俋俋俁擭偺曢傟偺偙偲偱丄俿俰偺峔憿偲婡擻偺
棟夝偑堦婥偵恑傓偐偲巚傢傟傑偟偨丅偟偐偟丄幚嵺偵偼丄僆僋儖僨傿儞偺傾儈僲巁攝楍偑庬娫偱戝偒偔曄摦偟偰偄偨偨傔偵丄儅僂僗傗僸僩偺僆僋儖僨傿儞偺摨掕偼擄峲偟丄寖偟偄崙嵺嫞憟偺拞偱丄彊乆偵廩幚偟偰偒偨堚揱巕偺僨乕僞儀乕僗偺拞偐傜丄塣椙偔変乆偑僸僩偺僆僋儖僨傿儞偺堦晹偺攝楍傪尒偮偗丄傛偆傗偔傎擕椶偺僆僋儖僨傿儞偺摨掕偵惉岟偡傞傑偱偵栺3擭偺帪娫偑昁梫偱偟偨5,6)丅
丂堦曽偱丄僯儚僩儕偱偼偁傞偑丄俿俰偺撪嵼惈枌抈敀幙偑尒偮偐偭偨偲偄偆偙偲偱丄懡偔偺尋媶幒偱僆僋儖僨傿儞偺婡擻夝愅偑巒傑傝傑偟偨7-14)丅偦偺寢壥丄僆僋儖僨傿儞偑俿俰僗僩儔儞僪偺宍惉傪捠偟偰丄俿俰偺婡擻傪捈愙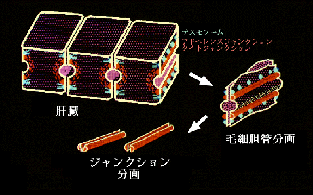 扴偭偰偄傞偲偄偆偙偲傪庡挘偡傞榑暥偑師乆偲敪昞偝傟傞傛偆偵側傝傑偟偨丅偟偐偟丄変乆偼丄摉帪丄杮摉偵僆僋儖僨傿儞偩偗偱俿俰僗僩儔儞僪偑宍惉偝傟偰偄傞偺偐偳偆偐偵偮偄偰丄彊乆偵媈栤傪帩偮傛偆偵側傝15)丄偙偺傛偆側媈栤偵捈愙摎偊傞偨傔偵丄僆僋儖僨傿儞偺堚揱巕偺僲僢僋傾僂僩傪帋傒傑偟偨丅偦偺寢壥丄梊憐奜側偙偲偵丄僆僋儖僨傿儞傪敪尰偟側偄忋旂嵶朎偱傕棫攈側俿俰僗僩儔儞僪偺僱僢僩儚乕僋偑宍惉偝傟傞偙偲偑暘偐傝傑偟偨16,17)丅偙偺変乆偵偲偭偰徴寕揑側帠幚偼丄僆僋儖僨傿儞偑側偔偰傕俿俰僗僩儔儞僪偑宍惉偝傟傞丄偡側傢偪俿俰僗僩儔儞僪傪峔惉偡傞枌抈敀幙偼僆僋儖僨傿儞埲奜偵懚嵼偡傞丄偲偄偆偙偲傪堄枴偟偰偄傑偟偨丅
扴偭偰偄傞偲偄偆偙偲傪庡挘偡傞榑暥偑師乆偲敪昞偝傟傞傛偆偵側傝傑偟偨丅偟偐偟丄変乆偼丄摉帪丄杮摉偵僆僋儖僨傿儞偩偗偱俿俰僗僩儔儞僪偑宍惉偝傟偰偄傞偺偐偳偆偐偵偮偄偰丄彊乆偵媈栤傪帩偮傛偆偵側傝15)丄偙偺傛偆側媈栤偵捈愙摎偊傞偨傔偵丄僆僋儖僨傿儞偺堚揱巕偺僲僢僋傾僂僩傪帋傒傑偟偨丅偦偺寢壥丄梊憐奜側偙偲偵丄僆僋儖僨傿儞傪敪尰偟側偄忋旂嵶朎偱傕棫攈側俿俰僗僩儔儞僪偺僱僢僩儚乕僋偑宍惉偝傟傞偙偲偑暘偐傝傑偟偨16,17)丅偙偺変乆偵偲偭偰徴寕揑側帠幚偼丄僆僋儖僨傿儞偑側偔偰傕俿俰僗僩儔儞僪偑宍惉偝傟傞丄偡側傢偪俿俰僗僩儔儞僪傪峔惉偡傞枌抈敀幙偼僆僋儖僨傿儞埲奜偵懚嵼偡傞丄偲偄偆偙偲傪堄枴偟偰偄傑偟偨丅
叄丏扨憌忋旂偺僶儕傾乕傪扴偆僋儘乕僨傿儞僼傽儈儕乕偺敪尒
丂偦偙偱丄変乆偼丄僆僋儖僨傿儞偲壗傜偐偺堄枴偱憡屳嶌梡偡傞枌抈敀幙傪扵偡偲偄偆曽岦偱丄偙偺枹摨掕偺俿俰枌抈敀幙傪扵偦偆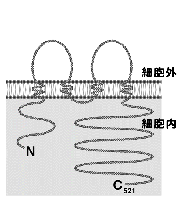 偲偟傑偟偨丅yeast two-hybrid朄傗柶塽捑崀朄傪帋傒傑偟偨偑惉岟偣偢丄忋婰偺僕儍儞僋僔儑儞偺扨棧暘夋偵擹弅偡傞枌抈敀幙偺拞偱丄庬乆偺忦審壓乮挻壒攇攋夡傗潋摐枾搙岡攝墦怱乯偱僆僋儖僨傿儞偲嫇摦傪偲傕偵偡傞傕偺傪扵偟傑偟偨丅偦偺寢壥丄嵟廔揑偵丄揹婥塲摦忋俀俁倠俢倎偺暘巕検傪帵偡抈敀幙偑岓曗偲偟偰巆傝丄偦偺傾儈僲巁攝楍傪寛掕偟偨偲偙傠丄俀偮偺俤俽俿僋儘乕儞偵堦抳偟傑偟偨丅偙傟傜偺俤俽俿僋儘乕儞偐傜慡挿偺堚揱巕傪扨棧偟偨偲偙傠丄屳偄偵傾儈僲巁儗儀儖偱栺俁侽亾偺儂儌儘僕乕傪帵偡俀庬椶偺俀俁倠俢倎抈敀幙傪僐乕僪偡傞們俢俶俙偑摨掕偝傟傑偟偨18-20)乮傕偲傕偲偺俀俁倠俢倎偺僶儞僪偑彮側偔偲傕俀庬椶埲忋偺抈敀幙偺崿崌暔偩偭偨偙偲偵側傝傑偡乯丅偍傕偟傠偄偙偲偵丄偙傟傜偺抈敀幙偼偦偺傾儈僲巁攝楍偐傜丄傗偼傝係夞枌娧捠宆偺撪嵼惈枌抈敀幙偲巚傢傟偨偺偱偡偑丄僆僋儖僨傿儞偲偼慡偔儂儌儘僕乕傪帵偟傑偣傫偱偟偨乮恾俆乯丅
偄偢傟偺抈敀幙傕僞僌傪偮偗偰忋旂嵶朎偵敪尰偝偣傞偲俿俰僗僩儔儞僪偵庢傝崬傑傟傞偙偲偑暘偐傝傑偟偨偺偱丄偙偺帪揰偱僋儘乕僨傿儞亅侾偲亅俀乮claudin-1,-2丗儔僥儞岅偺claudere丄暵偠傞偺堄丄偐傜乯偲柤晅偗傑偟偨丅
偲偟傑偟偨丅yeast two-hybrid朄傗柶塽捑崀朄傪帋傒傑偟偨偑惉岟偣偢丄忋婰偺僕儍儞僋僔儑儞偺扨棧暘夋偵擹弅偡傞枌抈敀幙偺拞偱丄庬乆偺忦審壓乮挻壒攇攋夡傗潋摐枾搙岡攝墦怱乯偱僆僋儖僨傿儞偲嫇摦傪偲傕偵偡傞傕偺傪扵偟傑偟偨丅偦偺寢壥丄嵟廔揑偵丄揹婥塲摦忋俀俁倠俢倎偺暘巕検傪帵偡抈敀幙偑岓曗偲偟偰巆傝丄偦偺傾儈僲巁攝楍傪寛掕偟偨偲偙傠丄俀偮偺俤俽俿僋儘乕儞偵堦抳偟傑偟偨丅偙傟傜偺俤俽俿僋儘乕儞偐傜慡挿偺堚揱巕傪扨棧偟偨偲偙傠丄屳偄偵傾儈僲巁儗儀儖偱栺俁侽亾偺儂儌儘僕乕傪帵偡俀庬椶偺俀俁倠俢倎抈敀幙傪僐乕僪偡傞們俢俶俙偑摨掕偝傟傑偟偨18-20)乮傕偲傕偲偺俀俁倠俢倎偺僶儞僪偑彮側偔偲傕俀庬椶埲忋偺抈敀幙偺崿崌暔偩偭偨偙偲偵側傝傑偡乯丅偍傕偟傠偄偙偲偵丄偙傟傜偺抈敀幙偼偦偺傾儈僲巁攝楍偐傜丄傗偼傝係夞枌娧捠宆偺撪嵼惈枌抈敀幙偲巚傢傟偨偺偱偡偑丄僆僋儖僨傿儞偲偼慡偔儂儌儘僕乕傪帵偟傑偣傫偱偟偨乮恾俆乯丅
偄偢傟偺抈敀幙傕僞僌傪偮偗偰忋旂嵶朎偵敪尰偝偣傞偲俿俰僗僩儔儞僪偵庢傝崬傑傟傞偙偲偑暘偐傝傑偟偨偺偱丄偙偺帪揰偱僋儘乕僨傿儞亅侾偲亅俀乮claudin-1,-2丗儔僥儞岅偺claudere丄暵偠傞偺堄丄偐傜乯偲柤晅偗傑偟偨丅
丂偙偺僋儘乕僨傿儞偼梊憐傕弌棃側偄傛偆側嫮椡側俿俰宍惉擻椡傪桳偟偰偄傑偟偨21,22)丅丂僋儘乕僨傿儞亅 侾傑偨偼亅俀傪俿俰傪帩偨側偄儅僂僗俴慄堐夎嵶朎偵嫮惂敪尰偝偣偨偲偙傠丄偄偢傟偺応崌傕丄傕偲傕偲嵶朎娫愙拝妶惈傪帵偝側偄俴嵶朎偑屳偄偵嫮屌偵愙拝偡傞傛偆偵側傝丄偝傜偵嬃偄偨偙偲偵嵶朎娫偵嫄戝側俿俰僗僩儔儞僪僱僢僩儚乕僋偑宍惉偝傟傑偟偨乮恾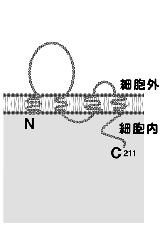 俇乯丅偙偺偙偲偼丄俿俰僗僩儔儞僪偑僋儘乕僨傿儞亅侾偍傛傃亅俀偩偗偱嵞峔惉偝傟傞偙偲傪堄枴偟偰偍傝丄偙偺憸傪揹巕尠旝嬀偺壓偱弶傔偰尒偨偲偒偺姶摦偼崱偱傕朰傟傜傟傑偣傫丅
俇乯丅偙偺偙偲偼丄俿俰僗僩儔儞僪偑僋儘乕僨傿儞亅侾偍傛傃亅俀偩偗偱嵞峔惉偝傟傞偙偲傪堄枴偟偰偍傝丄偙偺憸傪揹巕尠旝嬀偺壓偱弶傔偰尒偨偲偒偺姶摦偼崱偱傕朰傟傜傟傑偣傫丅
丂堦曽偱丄僋儘乕僨傿儞亅侾偲亅俀偺懚嵼偼丄僋儘乕僨傿儞堚揱巕偑僼傽儈儕乕傪宍惉偟偰偄傞偙偲傪堄枴偟偰偄傑偟偨丅 偦偙偱丄変乆偼丄僨乕僞儀乕僗傪傕偲偵丄僋儘乕僨傿儞亅侾偲亅俀偵攝楍偺帡偨堚揱巕傪摨掕偟偰偄偭偨偲偙傠丄嵟廔揑偵僋儘乕僨傿儞僼傽儈儕乕偼儅僂僗偱彮側偔偲傕俀係庬椶偺儊儞僶乕偐傜側傝丄偙傟傜偺僋儘乕僨傿儞偑奺憻婍偱暋嶨側慻傒崌傢偣偱敪尰偟偰偄傞偙偲偑柧傜偐偵側傝傑偟偨20,23-25)乮恾俈乯丅偝傜偵丄偙偙偱偼彮偟暋嶨偵側傝傑偡偺偱徣棯偟傑偡偑丄嵶朎儗儀儖偱偺徻嵶側夝愅偵傛傝丄乽俀庬椶埲忋偺僋儘乕僨傿儞偑嫟廳崌偟偰僿僥儘億儕儅乕偱偁傞俿俰僗僩儔儞僪傪宍惉偟丄岦偐偄崌偆嵶朎枌拞偺僗僩儔儞僪偳偆偟偑僋儘乕僨傿儞娫偺僿僥儘僼傿儕僢僋側愙拝偵傛傝懳崌偟偰丄嵶朎枌娫偺嫍棧傪僛儘偵偟偰偄傞偺偑丄俿俰偱偁傞乿偲偄偆
偙偲偑暘偐傝傑偟偨26)乮恾俉乯丅
丂師偵丄摉慠丄偙傟傜偺僋儘乕僨傿儞暘巕偑丄俿俰偺僶儕傾乕婡擻傪杮摉偵扴偭偰偄傞偺偐偲偄偆偙偲偑栤戣偵側傝傑偟偨丅 僋儘乕僨傿儞偑幚嵺偵俿俰僗僩儔儞僪傪嶌傞偺偱偡偐傜丄俿俰偺僶儕傾乕婡擻偵捈愙偐偐傢偭偰偄傞偙偲偼摉慠偺傛偆偵巚偊傞偺偱偡偑丄俿俰偺僶儕傾乕婡擻偵娭偟偰偼丄屆偔偐傜懡偔偺徻嵶側惗棟妛揑夝愅偑側偝傟偰偍傝丄偙傟傜偑俀係庬椶偺僋儘乕僨傿儞偵傛偭偰偳偺傛偆偵愢柧偝傟傞偺偱偁傠偆偐丄偲偄偆偙偲偑戝偒側栤戣偵側偭偰偒傑偟偨丅偙偺栤戣傕丄懡嵶朎惗暔偺僶儕傾乕傪峫偊傞忋偱丄偒傢傔偰杮幙揑側栤戣偱偡偑丄偁傑傝偵傕愱栧揑偵側傝傑偡偺偱丄偙偙偱偼偦偺徻嵶偼徣棯偝偣偰偄偨偩偒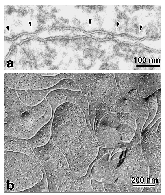 傑偡丅偨偩丄変乆偺尋媶偐傜柧傜偐偵側偭偨偙偲傪売忦彂偒偵偟傑偡偲丄師偺傛偆偵側傝傑偡丅
傑偡丅偨偩丄変乆偺尋媶偐傜柧傜偐偵側偭偨偙偲傪売忦彂偒偵偟傑偡偲丄師偺傛偆偵側傝傑偡丅
侾丏 僋儘乕僨傿儞偼椬傝崌偭偨嵶朎偲偺娫偱懳崌偡傞俿俰僗僩儔儞僪傪宍惉偡傞偙偲偱丄俿俰偺僶儕傾乕婡擻傪捈愙扴偭偰偄傞27,28)丅
俀丏 俿俰僗僩儔儞僪偺僶儕傾乕婡擻偵偼丄偐側傝僞僀僩側傕偺偐傜丄偐側傝儖乕僘側傕偺傑偱偁傞偙偲偑抦傜傟偰偄偨偑丄偦傟偼懳崌偡傞俿俰僗僩儔儞僪傪峔惉偡傞僋儘乕僨傿儞偺慻傒崌傢偣偲丄偦偺崿崌斾偵傛偭偰寛掕偝傟偰偄傞丅尵偄姺偊傟偽丄偧傟偧傟扨撈偱傕俿俰僗僩儔儞僪傪宍惉偱偒傞俀係庬椶傕偺僋儘乕僨傿儞偑懚嵼偡傞堄枴偼丄庬乆偺儗儀儖偺摟夁惈傪帩偭偨俿俰僗僩儔儞僪傪嶌傞偨傔偱偼側偄偐偲峫偊傜傟傞29,30)丅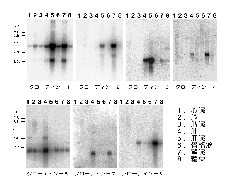
叅丏廳憌忋旂偺僶儕傾乕偲僋儘乕僨傿儞
丂偙傟傑偱偺媍榑偼堦憌偺嵶朎偐傜側傞扨憌忋旂偵峣偭偰峴偭偰偒傑偟偨31-33)丅偟偐偟丄幚嵺偵偼丄懡憌偺嵶朎偐傜側傞乽廳憌忋旂乿傕丄懡嵶朎惗暔偺懱傪奜奅偐傜妘棧偟丄傑偨丄懱偺拞偵懡偔偺僐儞僷乕僩儊儞僩傪嶌傞偨傔偵廳梫側栶妱傪壥偨偟偰偄傑偡丅摿偵丄懱偺昞柺偺戝晹暘傪暍偆昞旂偼丄揟宆揑側廳憌滸暯忋旂偱丄偦偺僶儕傾乕婡擻偼変乆偺惗懚偵偲偭偰昁梫晄壜寚側傕偺偱偡丅堦斒偵昞旂偼丄恀旂懁偐傜丄婎掙憌丄桳灆憌丄梓棻憌丄妏幙憌偺係憌偐傜側傞偲偝傟偰偄傑偡丅偙傟傑偱廳憌忋旂偵偼俿俰偼懚嵼偣偢丄偦偺僶儕傾乕婡擻偺懡偔偼丄巰傫偩嵶朎偐傜側傞妏幙憌偵傛偭偰扴傢傟偰偄傞偲峀偔怣偠傜傟偰偒傑偟偨丅変乆偼丄僲僢僋傾僂僩儅僂僗偺夝愅偐傜丄偛偔嵟嬤丄偙偺廬棃偺峫偊傪崻杮偐傜暍偡偙偲偵側傝傑偟偨丅

丂変乆偼丄屄懱儗儀儖偵偍偗傞僋儘乕僨傿儞偺婡擻傪挷傋傞偨傔偵丄嵟嬤偄偔偮偐偺僋儘乕僨傿儞堚揱巕傪攋夡偟偨儅僂僗偺嶌惢傪巒傔傑偟偨丅嵟弶偵摼傜傟偨僋儘乕僨傿儞亅侾僲僢僋傾僂僩儅僂僗偼丄堦尒惓忢偵惗傑傟偰偒傑偟偨偑丄俀係帪娫埲撪偵旂晢偐傜偺悈暘偺忲嶶検偑堎忢偵懡偄偨傔偵扙悈偵娮傝丄偡傋偰偑巰傫偱偄偒傑偟偨34)乮恾俋乯丅偦偙偱丄変乆偼丄昞旂偵偼俿俰偑懚嵼偟側偄偲偄偆偙傟傑偱偺嫵壢彂揑側婰嵹偑娫堘偭偰偄傞偺偱偼側偄偐偲峫偊丄徻嵶側専摙傪峴側偄傑偟偨丅
偦偺寢壥丄梊憐捠傝丄廳憌忋旂偱偁傞昞旂偱傕梓棻憌偵楢懕偟偨俿俰偑懚嵼偟丄偙偺俿俰偼僋儘乕僨傿儞亅侾偲亅係乮偍傛傃僆僋儖僨傿儞乯偐傜弌棃偰偄傞偙偲偑柧傜偐偵側傝傑偟偨乮恾侾侽乯丅僋儘乕僨傿儞亅侾僲僢僋傾僂僩儅僂僗偺昞旂偱傕丄僋儘乕僨傿儞亅係偐傜側傞俿俰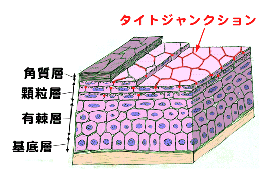 偼楢懕偟偰梓棻憌偵懚嵼偟偰偄傑偟偨偑丄旂壓偵拲幩偟偨僩儗乕僒乕偑惓忢側旂晢偱偼俿俰傛傝懱昞柺懁偵楻傟側偄偺偵懳偟偰丄僋儘乕僨傿儞亅侾傪寚懝偟偨旂晢偱偼柧傜偐偵楻傟傞偙偲偑暘偐傝傑偟偨丅
偼楢懕偟偰梓棻憌偵懚嵼偟偰偄傑偟偨偑丄旂壓偵拲幩偟偨僩儗乕僒乕偑惓忢側旂晢偱偼俿俰傛傝懱昞柺懁偵楻傟側偄偺偵懳偟偰丄僋儘乕僨傿儞亅侾傪寚懝偟偨旂晢偱偼柧傜偐偵楻傟傞偙偲偑暘偐傝傑偟偨丅
丂埲忋偺敪尒偼丄俿俰丄摿偵丄僋儘乕僨傿儞偑丄扨憌忋旂 偩偗偱側偔丄廳憌忋旂偺僶儕傾乕偵偍偄偰傕拞怱揑栶妱傪壥偨偟偰偄傞偙偲傪弶傔偰帵偟偨傕偺偱丄旂晢壢妛傪偼偠傔偲偡傞堛妛惗暔妛偵戝偒側嬃偒傪梌偊偨偲巚偄傑偡35-37)丅
叆丏偍傢傝偵
丂埲忋丄変乆偑僆僋儖僨傿儞丄偦偟偰僋儘乕僨傿儞偺摨掕傪婡偵愗傝奐偄偰偒偨乽僶儕傾乕偺暘巕惗暔妛乿偲偱傕屇傇傋偒尋媶暘栰偺尰忬傪娙扨偵徯夘偝偣偰偄偨偩偒傑偟偨丅偙傟偐傜偼丄俿俰偺僶儕傾乕婡擻丄偍傛傃偦偺挷愡婡擻偑丄懡嵶朎惗暔偺屄懱宍惉偺忋偱偳偺傛偆偵廳梫側栶妱傪壥偨偟偰偄傞偐偑丄偦傟偧傟偺僋儘乕僨傿儞堚揱巕偺僲僢僋傾僂僩儅僂僗偺嶌惢傪偼偠傔偲偡傞庬乆偺夝愅偵傛傝丄媫懍偵柧傜偐偵偝傟偰偄偔偲巚偄傑偡丅傑偨丄僶儕傾乕婡擻偺堎忢丄摿偵僋儘乕僨傿儞婡擻偺堎忢偲偝傑偞傑側幘姵丒昦懺偲偺娭學傕柧傜偐偵側偭偰偔傞偲巚偄傑偡38-40)丅偡偱偵俀偮偺僸僩偺堚揱惈幘姵乮堚揱惈掅儅僌僱僔僂儉寣徢偲堚揱惈擄挳乯偑偦傟偧傟僋儘乕僨傿儞亅侾俇偲亅侾係偺曄堎偵傛傝堷偒婲偙偝傟傞偙偲偑曬崘偝傟偰偄傑偡偟33)丄儅僂僗偺夝愅偐傜峫偊傞偲丄僶儕傾乕忈奞傪敽偭偨僸僩偺堚揱惈偺旂晢幘姵偺拞偵僋儘乕僨傿儞偺曄堎偑尒偮偐傞壜擻惈傕崅偄偲巚傢傟偰偄傑偡丅僋儘乕僨傿儞偵娭楢偟偨僸僩堚揱昦偺摨掕偼丄偙傟偐傜媫懍偵恑傓偱偟傚偆丅
丂堦曽偱丄変乆偼丄僋儘乕僨傿儞偺婡擻晄慡偲歜懅丒傾僩僺乕丒僋儘乕儞昦側偳偺枬惈墛徢偲偺娭學偵傕嫽枴傪帩偭偰偄傑偡丅傑偨丄僋儘乕僨傿儞偺敪尰傗婡擻傪憖嶌偡傞偙偲偵傛偭偰俿俰偺僶儕傾乕婡擻傪恖堊揑偵憖嶌偡傞曽朄偑妋棫偱偒傟偽丄堛妛揑堄媊偼戝偒偄偲巚偄傑偡丅幚嵺偵丄嵟嬤丄擼寣娗偵戝検偵敪尰偟偰偄傞僋儘乕僨傿儞亅俆偺僲僢僋傾僂僩儅僂僗偱偼丄掅暘巕検暔幙偵懳偡傞擼寣娗娭栧偑攋夡偝傟偰偄傞偙偲傪尒偄偩偟偰偍傝丄僋儘乕僨傿儞傪僞乕僎僢僩偲偟偨怴偟偄僪儔僢僌僨儕僶儕乕朄偺奐敪傕尰幚揑側傕偺偵側偭偰偔傞偐傕偟傟傑偣傫丅
丂崱擔偼丄慡偔怗傟傑偣傫偱偟偨偑丄僋儘乕僨傿儞偺敪尒偵傛偭偰丄忋旂嵶朎傗撪旂嵶朎偺嬌惈宍惉偵偍偗傞俿俰偺栶妱偺棟夝傕暘巕儗儀儖偱怺傑傝偮偮偁傝傑偡丅俿俰僗僩儔儞僪偼丄傾僺僇儖枌僪儊僀儞偲僶僜儔僥儔儖枌僪儊僀儞偺娫偵丄僆僀儖僼僃儞僗偺傛偆偵挘傝弰傜偝傟偰偄傞偨傔丄擇偮偺僪儊僀儞傪暘偗傞栶妱乮僼僃儞僗婡擻乯傪壥偨偟偰偄傑偡丅傑偨丄俿俰僗僩儔儞僪偺嵶朎幙懁偵偼丄僆僋儖僨傿儞丒僋儘乕僨傿儞偲捈愙寢崌偡傞ZO-1丄ZO-2丄ZO-3側偳偺棤懪偪抈敀幙偺懠偵丄庬乆偺忋旂嵶朎偺宍懺宍惉僔僌僫儖傪扴偆偲巚傢傟傞場巕偑廤愊偟偰偄傞偙偲偑嵟嬤柧傜偐偵側傝偮偮偁傝傑偡丅偙偺傛偆側嬌惈宍惉僔僌僫儖揱払偺僙儞僞乕偺堦偮偲偟偰偺俿俰偺栶妱偺夝愅傕丄僋儘乕僨傿儞偺摨掕偵傛傝媫懍偵恑揥偟偰偔傞傕偺偲巚傢傟傑偡41-49)丅
暥專
1) Tsukita,Sh. & Tsukita,Sa.: Isolation of cell-to-cell
adherens junction from rat liver. J.Cell Biol. 108:31-41,
1989.
2) Itoh,M., Yonemura,S., Nagafuchi,A., Tsukita,Sa. & Tsukita,Sh.:
A 220kD undercoat-constitutive protein: Its specific localization
at cadherin-based cell-to-cell adhesion sites. J.Cell Biol.
115:1449-1462, 1991.
3) Itoh,M., Nagafuchi,A., Yonemura,S., Yasuda-Kitani,T., Tsukita,Sa.
& Tsukita,Sh.: The 220kD protein colocalizing with cadherins
in non-epithelial cells is identical to ZO-1, a tight junction-associated
protein in epithelial cells: cDNA cloning and immunoelectron microscopy.
J.Cell Biol. 121:491-502, 1993.
4) Furuse,M., Hirase,T., Itoh,M., Nagafuchi,A., Yonemura,S., Tsukita,Sa.
& Tsukita,Sh.: Occludin: A novel integral membrane protein
localizing at tight junctions. J.Cell Biol. 123:1777-1788,
1993.
5) Ando-Akatsuka,Y., Saitou,M., Hirase,T., Kishi,M., Sakakibara,A.,
Itoh,M., Yonemura,S., Furuse,M. & Tsukita,Sh.: Interspecies
diversity of the occludin sequence: cDNA cloning of human, mouse,
dog and rat-kangaroo homologues. J.Cell Biol. 133:43-47,
1996.
6) Saitou,M., Akatsuka-Ando,Y., Itoh,M., Furuse,M., Inazawa,J.,
Fujimoto,K. & Tsukita,Sh.: Mammalian occludin in epithelial
cells: Its expression and subcellular distribution. Eur.J.Cell
Biol. 73:222-231, 1997.
7) Furuse,M., Itoh,M., Hirase,T., Nagafuchi,A., Yonemura,S., Tsukita,Sa.
& Tsukita,Sh.: Direct association of occludin with ZO-1 and
its possible involvement in the localization of occludin at tight
junctions. J.Cell Biol. 127:1617-1626, 1994.
8) Furuse,M., Fujimoto,K., Sato,N., Hirase,T., Tsukita,Sa. &
Tsukita,Sh.: Overexpression of occludin, a tight junction-associated
integral membrane protein, induces the formation of intracellular
multilamellar bodies bearing tight junction-like structures. J.Cell
Sci. 109:429-435, 1996.
9) Tsukita,Sh., Furuse,M. & Itoh,M.: Molecular dissection
of tight junctions. Cell Struct. Funct. 21:381-385,
1996.
10) McCarthy,K.M., Skare,I.B., Stankewich,M.C., Furuse,M., Tsukita,Sh.,
Rogers,R.A., Lynch,R.D. & Schneeberger,E.E.: Occludin is a
functional component of the tight junction. J.Cell Sci.
109:2287-2298, 1996.
11) Sakakibara,A., Furuse,M., Saitou,M., Ando-Akatsuka,Y. &
Tsukita,Sh.: Possible involvement of phosphorylation of occludin
in tight junction formation. J.Cell Biol. 137:1393-1401,
1997.
12) Hirase,T., Staddon,J.M., Saitou,M., Akatsuka-Ando,Y., Itoh,M.,
Furuse,M., Fujimoto,K., Tsukita,Sh. & Rubin,L.: Occludin as
a possible determinant of tight junction permeability in endothelial
cells. J.Cell Sci. 110:1603-1613, 1997.
13) Morita,K., Itoh,M., Saitou,M., Ando-Akatsuka,Y., Furuse,M.,
Yoneda,K., Imamura,S. & Tsukita,Sh.: Subcellular distribution
of tight junction-associated proteins, occludin, ZO-1 and ZO-2,
in rodent skin and its developmental changes. J.Inv.Dermatol.
110:862-866, 1998.
14) Hirase,T., Kawashima,S., Wong,E.Y.M., Ueyama,T., Rikitake,Y.,
Tsukita,Sh., Yokoyama,M. & Staddon,J.M.: Regulation of tight
junction permeability and occludin phosphorylation by RhoA-p160ROCK-dependent
and -independent mechanisms. J.Biol.Chem. 276:10423-10431,
2001.
15) Moroi,S., Saitou,M., Fujimoto,K., Sakakibara,A., Furuse,M.,
Yoshida,O. & Tsukita,Sh.: Occludin is concentrated at tight
junctions of mouse/rat but not human/guinea pig Sertoli cells
in testes. Am.J.Physiol. 274:C1708-C1717, 1998.
16) Saitou,M., Fujimoto,K., Doi,Y., Itoh,M., Fujimoto,T., Furuse,M.,
Takano,H., Noda,T. & Tsukita,Sh.: Occludin-deficient embryonic
stem cells can differentiate into polarized epithelial cells bearing
tight junctions. J.Cell Biol. 141:397-408, 1998.
17) Sitou,M., Furuse,M., Sasaki,H., Schulzke,J., Fromm,M., Takano,H.,
Noda,T. & Tsukita,Sh.: Complex phenotype of mice lacking occludin,
a component of tight junction strands. Mol.Biol.Cell 11:4131-4142,
2000.
18) Furuse,M., Fujita,K., Hiiragi,T., Fujimoto,K. & Tsukita,Sh.:
Claudin-1 and -2: Novel integral membrane proteins localizing
at tight junctions with no sequence similarity to occludin. J.Cell
Biol. 141:1539-1550, 1998.
19) Tsukita,Sh. & Furuse,M.: Overcoming barriers in the study
of tight junction functions: from occludin to claudin. Genes
Cells 3:569-573, 1998.
20) Tsukita,Sh. & Furuse,M.: Occludin and claudins in tight
junction strands: Leading or supporting players? Trends Cell
Biol. 9:268-273, 1999.
21) Furuse,M., Sasaki,H., Fujimoto,K. & Tsukita,Sh.: A single
gene product, claudin-1 or -2, reconstitutes tight junction strands
and recruits occludin in fibroblasts. J.Cell Biol. 143:391-401,
1998.
22) Kubota,K., Furuse,M., Sasaki,H., Sonoda,N., Fujita,K., Nagafuchi,A.
& Tsukita,Sh.: Ca++-independent cell adhesion activity of
claudins, integral membrane proteins of tight junctions. Curr.
Biol. 9:1035-1038, 1999.
23) Morita,K., Furuse,M., Fujimoto,K., & Tsukita,Sh.: Claudin
multigene family encoding four-transmembrane domain protein components
of tight junction strands. Proc.Natl.Acad.Sci.USA 96:511-516,
1999.
24) Morita,K., Sasaki,H., Fujimoto,K., Furuse,M., & Tsukita,Sh.:
Claudin-11/OSP-based tight junctions in myelinated sheaths of
oligodendrocytes and in Sertoli cells in testis. J.Cell Biol.
145:579-588, 1999.
25) Morita,K., Sasaki,H., Furuse,M. & Tsukita,Sh.: Endothelial
claudin: claudin-5/TMVCF constitutes tight junction strands in
endothelial cells. J.Cell Biol. 147:185-194, 1999.
26) Furuse,M., Sasaki,H. & Tsukita,Sh.: Manner of interaction
of heterogeneous claudin species within and between tight junction
strands. J.Cell Biol. 147:891-903, 1999.
27) Sonoda,N., Furuse,M., Sasaki,H., Yonemura,S., Katahira,J.,
Horiguchi,Y. & Tsukita,Sh.: Clostridium perfringens
enterotoxin fragment removes specific claudins from tight junction
strands: Evidence for direct involvement of claudins in tight
junction barrier. J.Cell Biol. 147:195-204, 1999.
28) Fujita,K., Katahira,J., Horiguchi,Y., Sonoda,N., Furuse,M.
& Tsukita,Sh.: Clostridium perfringens enterotoxin
binds to the second extracellular loop of claudin-3, a tight junction
integral membrane protein. FEBS Lett. 476:258-261,
2000.
29) Tsukita,Sh. & Furuse,M.: Pores in the wall: Claudins constitute
tight junction strands containing aqueous pores. J.Cell Biol.
149:13-16, 2000.
30) Furuse,M., Furuse,K., Sasaki,H. & Tsukita,Sh.: Conversion
of Zonula Occludentes from tight to leaky strand type by introducing
claudin-2 into MDCK I cells. J.Cell Biol. 153:263-272,
2001.
31) Tsukita,Sh.: Tight junctions involving occludin and claudins.
Cornea 19:S142-S145, 2000.
32) Tsukita,Sh. & Furuse,M.: The structure and function of
claudins, cell adhesion molecules at tight junctions. Ann.NY
Acad.Sci. 915:129-135, 2000.
33) Tsukita,Sh., Furuse,M. & Itoh,M.: Multi-functional strands
in tight junctions. Nature Rev.Mol.Cell Biol. 2:285-293,
2001.
34) Furuse,M., Hata,M., Furuse,K., Yoshida,Y., Haratake,A., Sugitani,Y.,
Noda,T., Kubo,A. & Tsukita,Sh.: Claudin-based tight junctions
are crucial for the mammalian epidermal barrier: A lesson from
claudin-1-deficient mice. J.Cell Biol. 156:1099-1111,
2002.
35) Tsukita,Sh. & Furuse,M.: Claudin-based barrier in simple
and stratified cellular sheets. Curr.Opin.Cell Biol. 14:531-536,
2002.
36) Morita,K., Furuse, M., Yoshida,Y., Itoh,M., Sasaki,H., Tsukita,Sh.
& Miyachi,Y.: Molecular architecture of tight junctions of
periderm differs from that of the maculae occludentes of epidermis.
J.Invest.Dermatol. 118:1073-1079, 2002.
37) Morita,K., Sasaki,H., Furuse,K., Furuse,M., Tsukita,Sh., &
Miyachi,Y.: Expression of claudin-5 in dermal vascular endothelia.
Exp.Dermatol. in press, 2002.
38) Michl,P., Buchholz,M., Rolke,M., Kunsch,S., Lohr,M., McClane,B.,
Tsukita,Sh., Leder,G., Adler,G. & Gress,T.M.: Claudin-4: A
new target for pancreatic cancer treatment using Clostridium perfringens
enterotoxin. Gastroenterology 121:678-684, 2001.
39) Miwa,N., Furuse,M., Tsukita,Sh., Niikawa,N., Nakamura,Y. &
Furukawa,Y.: Involvement of claudin-1 in the beta-catenin/Tcf
signaling pathway and its frequent upregulation in human colorectal
cancers. Oncology Res. 12:469-476, 2001.
40) Kiuchi-Saishin,Y., Furuse,M., Takasuga,A. & Tsukita,Sh.:
Differential patterns of expression of claudin isoforms, tight
junction membrane proteins, in mouse nephron segments. J.Am.Soc.Nephrol.
13:875-886, 2002.
41) Tsukita,Sh., Itoh,M., Nagafuchi,A., Yonemura,S., & Tsukita,Sa.:
Submembranous junctional plaque proteins include potential tumor
suppressor molecules. J.Cell Biol. 123:1049-1053,
1993.
42) Takeda,H., & Tsukita,Sh.: Effects of tyrosine phosphorylation
on tight junctions in temperature-sensitive v-src-transfected
MDCK cells. Cell Struct.Funct. 20:387-393, 1995.
43) Itoh,M., Nagafuchi,A., Moroi,S. & Tsukita,Sh.: Involvement
of ZO-1 in cadherin-based cell adhesion through its direct binding
to _ catenin and actin filaments. J.Cell Biol. 138:181-192,
1997.
44) Itoh,M., Morita,K. & Tsukita,Sh.: Characterization of
ZO-2 as a MAGUK family member associated with tight and adherens
junctions with a binding affinity to occludin and a catenin. J.Biol.Chem.
274:5981-5986, 1999.
45) Ando-Akatsuka,Y., Yonemura,S., Itoh,M., Furuse,M. & Tsukita,Sh.:
Differential behavior of E-cadherin and occludin in their colocalization
with ZO-1 during the establishment of epithelial cell polarity.
J.Cell Physiol. 179:115-125, 1999.
46) Tsukita,Sh., Furuse,M. & Itoh,M.: Structural and signaling
molecules come together at tight junctions. Curr.Opin.Cell
Biol. 11:628-633, 1999.
47) Itoh,M., Furuse,M., Morita,K., Kubota,K. & Tsukita,Sh.:
Molecular basis for the recruitment of three MAGUKs, ZO-1, ZO-2
and ZO-3, to tight junctions: Direct binding of their first PDZ
domains to the COOH-termini of claudins. J.Cell Biol. 147:1351-1363,
1999.
48) Itoh,M., Sasaki,H., Furuse,M., Ozaki,H., Kita,T. & Tsukita,Sh.:
Junctional adhesion molecule (JAM) binds to PAR-3: a possible
mechanism for the recruitment of PAR-3 to tight junctions. J.Cell
Biol. 154:491-497, 2001.
49) Hamazaki,Y., Itoh,M., Furuse,M. & Tsukita,Sh.: Multi-PDZ-containing
protein 1 (MUPP1) is concentrated at tight junctions through its
possible interaction. J.Biol.Chem. 277:455-461,
2002.

 丂
丂 偙偺俿俰偼摿庩側愙拝憰抲偱丄挻敄愗曅憸偱尒傞偲丄偲偙傠偳偙傠偱岦偐偄崌偆嵶朎枌娫偺嫍棧偑僛儘偵傑偱嬤偯偄偰偄傑偡乮俿俰偺僉僢僔儞僌億僀儞僩偲屇偽傟傑偡乯丅傑偨丄搥寢妱抐儗僾儕僇朄偱娤嶡偡傞偲丄俿俰偺晹暘偱偼丄枌撪棻巕偑堦楍偵暲傫偩僗僩儔儞僪乮俿俰僗僩儔儞僪乯偑曇傒栚傪峔惉偟偰偄傑偡丅偙偺傛偆側娤嶡偐傜丄俿俰偺峔憿偼恾俀偺傛偆側傕偺偱偁傞偲憐憸偝傟偰偒傑偟偨丅偡側傢偪丄壗傜偐偺撪嵼惈枌抈敀幙偑嵶朎枌偺拞偱慄忬偵廳崌偟偰俿俰僗僩儔儞僪傪宍惉偟丄岦偐偄崌偆嵶朎枌拞偺俿俰僗僩儔儞僪偲懁柺偱懳崌偡傞偙偲偵傛傝僉僢僔儞僌億僀儞僩傪宍惉偡傞偲偄偆峔憿偱偡丅偟偐偟丄晄巚媍側偙偲偵丄偙偺俿俰僗僩儔儞僪傪峔惉偡傞撪嵼惈枌抈敀幙偺幚懱偼挿偄娫撲偵曪傑傟偰偍傝丄俿俰僗僩儔儞僪偑摿庩側帀幙偺媡儈僙儖偐傜弌棃偰偄傞偲偄偆帀幙愢傕桳椡帇偝傟傞傑偱偵側偭偰偄傑偟偨丅
偙偺俿俰偼摿庩側愙拝憰抲偱丄挻敄愗曅憸偱尒傞偲丄偲偙傠偳偙傠偱岦偐偄崌偆嵶朎枌娫偺嫍棧偑僛儘偵傑偱嬤偯偄偰偄傑偡乮俿俰偺僉僢僔儞僌億僀儞僩偲屇偽傟傑偡乯丅傑偨丄搥寢妱抐儗僾儕僇朄偱娤嶡偡傞偲丄俿俰偺晹暘偱偼丄枌撪棻巕偑堦楍偵暲傫偩僗僩儔儞僪乮俿俰僗僩儔儞僪乯偑曇傒栚傪峔惉偟偰偄傑偡丅偙偺傛偆側娤嶡偐傜丄俿俰偺峔憿偼恾俀偺傛偆側傕偺偱偁傞偲憐憸偝傟偰偒傑偟偨丅偡側傢偪丄壗傜偐偺撪嵼惈枌抈敀幙偑嵶朎枌偺拞偱慄忬偵廳崌偟偰俿俰僗僩儔儞僪傪宍惉偟丄岦偐偄崌偆嵶朎枌拞偺俿俰僗僩儔儞僪偲懁柺偱懳崌偡傞偙偲偵傛傝僉僢僔儞僌億僀儞僩傪宍惉偡傞偲偄偆峔憿偱偡丅偟偐偟丄晄巚媍側偙偲偵丄偙偺俿俰僗僩儔儞僪傪峔惉偡傞撪嵼惈枌抈敀幙偺幚懱偼挿偄娫撲偵曪傑傟偰偍傝丄俿俰僗僩儔儞僪偑摿庩側帀幙偺媡儈僙儖偐傜弌棃偰偄傞偲偄偆帀幙愢傕桳椡帇偝傟傞傑偱偵側偭偰偄傑偟偨丅 扴偭偰偄傞偲偄偆偙偲傪庡挘偡傞榑暥偑師乆偲敪昞偝傟傞傛偆偵側傝傑偟偨丅偟偐偟丄変乆偼丄摉帪丄杮摉偵僆僋儖僨傿儞偩偗偱俿俰僗僩儔儞僪偑宍惉偝傟偰偄傞偺偐偳偆偐偵偮偄偰丄彊乆偵媈栤傪帩偮傛偆偵側傝15)丄偙偺傛偆側媈栤偵捈愙摎偊傞偨傔偵丄僆僋儖僨傿儞偺堚揱巕偺僲僢僋傾僂僩傪帋傒傑偟偨丅偦偺寢壥丄梊憐奜側偙偲偵丄僆僋儖僨傿儞傪敪尰偟側偄忋旂嵶朎偱傕棫攈側俿俰僗僩儔儞僪偺僱僢僩儚乕僋偑宍惉偝傟傞偙偲偑暘偐傝傑偟偨16,17)丅偙偺変乆偵偲偭偰徴寕揑側帠幚偼丄僆僋儖僨傿儞偑側偔偰傕俿俰僗僩儔儞僪偑宍惉偝傟傞丄偡側傢偪俿俰僗僩儔儞僪傪峔惉偡傞枌抈敀幙偼僆僋儖僨傿儞埲奜偵懚嵼偡傞丄偲偄偆偙偲傪堄枴偟偰偄傑偟偨丅
扴偭偰偄傞偲偄偆偙偲傪庡挘偡傞榑暥偑師乆偲敪昞偝傟傞傛偆偵側傝傑偟偨丅偟偐偟丄変乆偼丄摉帪丄杮摉偵僆僋儖僨傿儞偩偗偱俿俰僗僩儔儞僪偑宍惉偝傟偰偄傞偺偐偳偆偐偵偮偄偰丄彊乆偵媈栤傪帩偮傛偆偵側傝15)丄偙偺傛偆側媈栤偵捈愙摎偊傞偨傔偵丄僆僋儖僨傿儞偺堚揱巕偺僲僢僋傾僂僩傪帋傒傑偟偨丅偦偺寢壥丄梊憐奜側偙偲偵丄僆僋儖僨傿儞傪敪尰偟側偄忋旂嵶朎偱傕棫攈側俿俰僗僩儔儞僪偺僱僢僩儚乕僋偑宍惉偝傟傞偙偲偑暘偐傝傑偟偨16,17)丅偙偺変乆偵偲偭偰徴寕揑側帠幚偼丄僆僋儖僨傿儞偑側偔偰傕俿俰僗僩儔儞僪偑宍惉偝傟傞丄偡側傢偪俿俰僗僩儔儞僪傪峔惉偡傞枌抈敀幙偼僆僋儖僨傿儞埲奜偵懚嵼偡傞丄偲偄偆偙偲傪堄枴偟偰偄傑偟偨丅 偲偟傑偟偨丅yeast two-hybrid朄傗柶塽捑崀朄傪帋傒傑偟偨偑惉岟偣偢丄忋婰偺僕儍儞僋僔儑儞偺扨棧暘夋偵擹弅偡傞枌抈敀幙偺拞偱丄庬乆偺忦審壓乮挻壒攇攋夡傗潋摐枾搙岡攝墦怱乯偱僆僋儖僨傿儞偲嫇摦傪偲傕偵偡傞傕偺傪扵偟傑偟偨丅偦偺寢壥丄嵟廔揑偵丄揹婥塲摦忋俀俁倠俢倎偺暘巕検傪帵偡抈敀幙偑岓曗偲偟偰巆傝丄偦偺傾儈僲巁攝楍傪寛掕偟偨偲偙傠丄俀偮偺俤俽俿僋儘乕儞偵堦抳偟傑偟偨丅偙傟傜偺俤俽俿僋儘乕儞偐傜慡挿偺堚揱巕傪扨棧偟偨偲偙傠丄屳偄偵傾儈僲巁儗儀儖偱栺俁侽亾偺儂儌儘僕乕傪帵偡俀庬椶偺俀俁倠俢倎抈敀幙傪僐乕僪偡傞們俢俶俙偑摨掕偝傟傑偟偨18-20)乮傕偲傕偲偺俀俁倠俢倎偺僶儞僪偑彮側偔偲傕俀庬椶埲忋偺抈敀幙偺崿崌暔偩偭偨偙偲偵側傝傑偡乯丅偍傕偟傠偄偙偲偵丄偙傟傜偺抈敀幙偼偦偺傾儈僲巁攝楍偐傜丄傗偼傝係夞枌娧捠宆偺撪嵼惈枌抈敀幙偲巚傢傟偨偺偱偡偑丄僆僋儖僨傿儞偲偼慡偔儂儌儘僕乕傪帵偟傑偣傫偱偟偨乮恾俆乯丅
偄偢傟偺抈敀幙傕僞僌傪偮偗偰忋旂嵶朎偵敪尰偝偣傞偲俿俰僗僩儔儞僪偵庢傝崬傑傟傞偙偲偑暘偐傝傑偟偨偺偱丄偙偺帪揰偱僋儘乕僨傿儞亅侾偲亅俀乮claudin-1,-2丗儔僥儞岅偺claudere丄暵偠傞偺堄丄偐傜乯偲柤晅偗傑偟偨丅
偲偟傑偟偨丅yeast two-hybrid朄傗柶塽捑崀朄傪帋傒傑偟偨偑惉岟偣偢丄忋婰偺僕儍儞僋僔儑儞偺扨棧暘夋偵擹弅偡傞枌抈敀幙偺拞偱丄庬乆偺忦審壓乮挻壒攇攋夡傗潋摐枾搙岡攝墦怱乯偱僆僋儖僨傿儞偲嫇摦傪偲傕偵偡傞傕偺傪扵偟傑偟偨丅偦偺寢壥丄嵟廔揑偵丄揹婥塲摦忋俀俁倠俢倎偺暘巕検傪帵偡抈敀幙偑岓曗偲偟偰巆傝丄偦偺傾儈僲巁攝楍傪寛掕偟偨偲偙傠丄俀偮偺俤俽俿僋儘乕儞偵堦抳偟傑偟偨丅偙傟傜偺俤俽俿僋儘乕儞偐傜慡挿偺堚揱巕傪扨棧偟偨偲偙傠丄屳偄偵傾儈僲巁儗儀儖偱栺俁侽亾偺儂儌儘僕乕傪帵偡俀庬椶偺俀俁倠俢倎抈敀幙傪僐乕僪偡傞們俢俶俙偑摨掕偝傟傑偟偨18-20)乮傕偲傕偲偺俀俁倠俢倎偺僶儞僪偑彮側偔偲傕俀庬椶埲忋偺抈敀幙偺崿崌暔偩偭偨偙偲偵側傝傑偡乯丅偍傕偟傠偄偙偲偵丄偙傟傜偺抈敀幙偼偦偺傾儈僲巁攝楍偐傜丄傗偼傝係夞枌娧捠宆偺撪嵼惈枌抈敀幙偲巚傢傟偨偺偱偡偑丄僆僋儖僨傿儞偲偼慡偔儂儌儘僕乕傪帵偟傑偣傫偱偟偨乮恾俆乯丅
偄偢傟偺抈敀幙傕僞僌傪偮偗偰忋旂嵶朎偵敪尰偝偣傞偲俿俰僗僩儔儞僪偵庢傝崬傑傟傞偙偲偑暘偐傝傑偟偨偺偱丄偙偺帪揰偱僋儘乕僨傿儞亅侾偲亅俀乮claudin-1,-2丗儔僥儞岅偺claudere丄暵偠傞偺堄丄偐傜乯偲柤晅偗傑偟偨丅 俇乯丅偙偺偙偲偼丄俿俰僗僩儔儞僪偑僋儘乕僨傿儞亅侾偍傛傃亅俀偩偗偱嵞峔惉偝傟傞偙偲傪堄枴偟偰偍傝丄偙偺憸傪揹巕尠旝嬀偺壓偱弶傔偰尒偨偲偒偺姶摦偼崱偱傕朰傟傜傟傑偣傫丅
俇乯丅偙偺偙偲偼丄俿俰僗僩儔儞僪偑僋儘乕僨傿儞亅侾偍傛傃亅俀偩偗偱嵞峔惉偝傟傞偙偲傪堄枴偟偰偍傝丄偙偺憸傪揹巕尠旝嬀偺壓偱弶傔偰尒偨偲偒偺姶摦偼崱偱傕朰傟傜傟傑偣傫丅 傑偡丅偨偩丄変乆偺尋媶偐傜柧傜偐偵側偭偨偙偲傪売忦彂偒偵偟傑偡偲丄師偺傛偆偵側傝傑偡丅
傑偡丅偨偩丄変乆偺尋媶偐傜柧傜偐偵側偭偨偙偲傪売忦彂偒偵偟傑偡偲丄師偺傛偆偵側傝傑偡丅


 偼楢懕偟偰梓棻憌偵懚嵼偟偰偄傑偟偨偑丄旂壓偵拲幩偟偨僩儗乕僒乕偑惓忢側旂晢偱偼俿俰傛傝懱昞柺懁偵楻傟側偄偺偵懳偟偰丄僋儘乕僨傿儞亅侾傪寚懝偟偨旂晢偱偼柧傜偐偵楻傟傞偙偲偑暘偐傝傑偟偨丅
偼楢懕偟偰梓棻憌偵懚嵼偟偰偄傑偟偨偑丄旂壓偵拲幩偟偨僩儗乕僒乕偑惓忢側旂晢偱偼俿俰傛傝懱昞柺懁偵楻傟側偄偺偵懳偟偰丄僋儘乕僨傿儞亅侾傪寚懝偟偨旂晢偱偼柧傜偐偵楻傟傞偙偲偑暘偐傝傑偟偨丅