-------------------------------------------------------------------------------------------------------------------------------------------------------------
膜蛋白質機能を制御する人工バインダー分子創製とその構造学的検証
トランスポーター,Gタンパク質共役受容体(GPCR),チャネル,イオンポンプといった種々の膜蛋白質は重要な創薬ターゲットであり,
それらの精密立体構造データに基づいた医薬品の分子設計・構造改変が可能となれば,より副作用の少ない新規の著効性化合物の発見を指向した
研究開発が加速されるものと期待される.しかしながら,ヒト・哺乳類の膜蛋白質のX線結晶構造を系統的・網羅的に解析してゆくことは依然として難しいため,
その方向性での研究は停滞している.
膜蛋白質のX線結晶構造解析が困難である最大の要因は,回折データ収集に必要な良質の結晶が得られる確率がきわめて低い点である.
膜蛋白質精製標品の調製においては界面活性剤を用いて可溶化するので,その疎水性領域(膜貫通部分)が界面活性剤のミセルで覆われていて
結晶格子が形成されにくい.私たちは,膜蛋白質にモノクローナル抗体フラグメントを結合させて膜外親水性表面を拡張すると結晶化が促進されること
に着眼し (図),これまでにヒト・哺乳類由来の膜蛋白質のX線結晶構造解析に資する基盤技術を確立した.また実際に結晶構造解析に用いた抗体の多くが,
膜蛋白質の機能を制御する機能性抗体(抗体医薬のシーズ)であることも明らかとなってきている.この研究戦略を敷衍して,種々の疾患の発症に関連し
た膜蛋白質に適用すれば,構造ベースの創薬を促す端緒となるだけでなく,取得した抗体自身も医薬品候補となるに違いない.
当グループでは,① 抗体/非抗体を問わず種々のタンパク質分子骨格を利用して,膜蛋白質の結晶化促進因子と機能制御因子としての特徴を併せもつ人工バインダー分子を探索・作製すること,② 得られた人工バインダーを用いて膜蛋白質との共結晶のX線構造解析を推進し,膜タンパク質機能の作動あるいは遮断を制御する機能性バインダーのファーマコフォア構造を解明すること,を目的として研究を進めている.
これまでの構造生物学は「自然界に存在する生命の部品を眺めて生物学的意味を解釈する」還元論的アプローチが主流であった.創薬標的となる膜蛋白質や細胞の機能を制御する人工バインダー(生物学的に意味のある人工的な部品)を分子設計・選抜の過程を経て自由自在に創出する技術を確立することによって,「生命現象をデザインして創って眺める」構成論的な潮流を生み出したいと考えている.
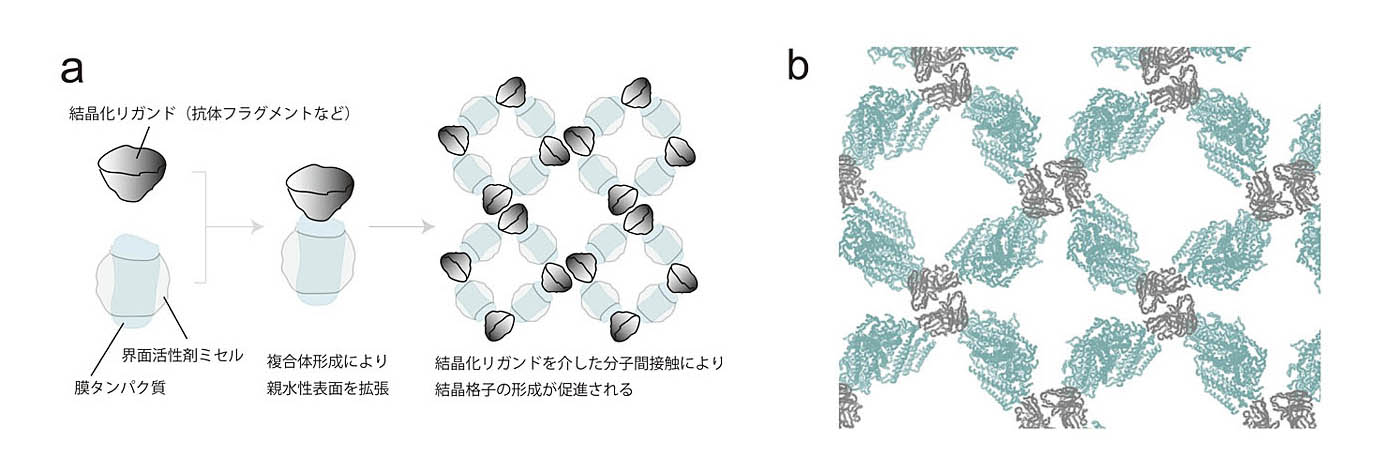
(図)抗体を用いた膜蛋白質の結晶化
(a)原理.「結晶化リガンド」とは,ターゲット膜蛋白質に特異的に結合して安定な複合体を形成し,結晶格子の形成を促進する補助分子のことである.
(b)膜蛋白質-Fv抗体フラグメント複合体の結晶パッキングの例.膜蛋白質とFvをそれぞれ淡青色と灰色で示した.Fvフラグメントは結晶中の分子間接触,三次元結晶格子の形成に重要な役割を果たしている.
-------------------------------------------------------------------------------------------------------------------------------------------------------------
重要な膜タンパク質の構造解析研究
近年の創薬研究において、効率良く標的タンパク質の立体構造情報を基にした創薬(SBDD: Structure-based drug design)が利用されるようになってきた。
SBDDの有名な例としては、インフルエンザウイルスの酵素ノイラミニダーゼの立体構造情報を利用して開発されたタミフルやリレンザなどが挙げられる。
しかしながら現在の創薬ターゲットの約半分は、立体構造解析の難しい膜タンパク質である。実際に、Protein Data Bankには9万個以上の構造データが登録されているが、
これまでに構造解析された膜タンパク質は約400種類しかなく、しかもそれらの殆どは細菌由来のもので、創薬上で重要なヒト由来のものは僅かしかない。
そのため、膜タンパク質を標的とする医薬品の開発にはSBDDの手法が有効に利用できず、膜タンパク質の構造情報の不足は創薬研究上のボトルネックとなっていた。
膜タンパク質の構造解析が可溶性タンパク質に比べて難しい理由は、①生体膜中に存在するため疎水性度が高く、精製のためには界面活性剤を利用して可溶化する
必要がある点、②膜タンパク質は動いて機能するものが多く、構造上の柔軟性のため不安定である点、③生体膜上に発現するため発現量が低い点などが挙げられる。
2005~2011年の間に当研究室で実施されたERATO 岩田ヒト膜受体構造プロジェクトでは、生命に必須である情報伝達に関与し、創薬ターゲットの30%以上を占める
Gタンパク質共役受容体(GPCR)を主な研究対象にして研究を行ってきた。そして、二種類の酵母(Saccharomyces cerevisiae, Pichia pastoris)の特徴を利用した
GPCRの大量発現系の迅速な構築方法の開発や、膜タンパク質を安定化させる構造認識抗体の作製手法の開発といった膜タンパク質の結晶化のための基盤技術の確立や、
構造認識抗体やキュービックフェーズ法を利用した膜タンパク質の結晶構造解析などに成功した。
当グループでは、ERATOプロジェクトで培った経験や技術を発展させるとともに、平成24年3月より共用が開始されたX線自由電子レーザー施設SACLAなどの
新しい技術も取り入れながら、GPCRを含め、重要な膜タンパク質の結晶化技術の開発や、膜タンパク質の迅速な構造解析を目指して研究を行っている(図1)。
更に、リガンドとの複合体構造を利用したin silicoスクリーニングや、立体構造とシミュレーションを組み合わせた膜タンパク質の機能解析などの共同研究も行っている。
これらの研究により、生命に必須な膜タンパク質の機能の理解を助けるとともに、製薬企業との連携などを通じて、立体構造情報を利用した創薬研究に役立てたいと考えている。
創薬ターゲット蛋白質の迅速構造解析法の開発
当グループは、X線自由電子レーザー重点戦略研究課題の一環である、「創薬ターゲット蛋白質の迅速構造解析法の開発」プロジェクトの参画機関となっている。
X線自由電子レーザー(XFEL: X-ray Free Electron Laser)とは、超高輝度、 高い空間コヒーレンス、 フェムト秒パルスという特別な性質を持つX線レーザーである。
つまり、結晶構造解析でXFELを利用すると、非常に強いX線レーザーの照射により微結晶からでもX線回折像を得られ、さらに、フェムト秒オーダーで照射できるため、
SPring-8などの放射光でのデータ収集でしばしば問題となる、「X線照射による化学結合の切断」が生じるより短い時間でデータを測定できる
「創薬ターゲット蛋白質の迅速構造解析法の開発」プロジェクトの目的は、平成24年3月より共用が開始されたX線自由電子レーザー施設SACLAを利用し、
医薬的に重要なタンパク質を迅速かつ高分解能で構造決定するための技術を確立することである。コア研究機関である理化学研究所では、多数のナノ結晶を
インジェクターで噴出し、それにXFELパルスを照射してデータを測定する装置を開発している。当グループでは、このような測定装置の開発のためのモデルタンパク質
の微結晶の調整や、XFELでのデータ測定を行うとともに、創薬的に重要な膜タンパク質の大量発現系の確立、結晶化を行っている。そして、
SPring-8では3.3Åの分解能だった膜タンパク質の結晶が、SACLAでは1.9Åの分解能を示すことを確認している(図2A・B)
-------------------------------------------------------------------------------------------------------------------------------------------------------------
生理活性ペプチドを受容するGPCRの構造生物学的研究
GPCRは、生体において様々な生理機能の調節を担っている7回膜貫通型受容体であり、重要な創薬ターゲットである。当グループでは、その中でも生理活性ペプチドを受容するGPCRの構造解析に焦点をあてて研究を行っている。
生理活性ペプチドは数~数十アミノ酸からなる作動薬であり、ムスカリン性アセチルコリン受容体M2のような低分子作動薬の受容体と比較すると、生理活性ペプチドと受容体の相互作用面は広範囲にわたると考えられる。従って、生理活性ペプチドと受容体の結合様式を知ることで、これまでにないGPCR特異的なリガンドやモジュレーターの設計に有用であると考えられる。しかし、膜タンパク質の構造解析自体が未だに高難度であるため、生理活性ペプチドを受容するGPCRの構造は少ないのが現状である。高難度である要因には、(1)タンパク質としての不安定さ、(2)結晶性の乏しさという問題がある。(1)は生理活性ペプチドなどの作動薬の結合により、GPCRの細胞内第3ループおよびそれを繋ぐ第5ヘリクスと第6ヘリクスが構造変化することに起因する。これは、細胞外の情報を細胞内へ伝えるために必須な機能である反面、結晶化にとっては足かせとなる。(2)はそもそもGPCRの膜外親水性表面が少ないことに加え、膜に発現しているGPCRを精製する際に界面活性剤のミセルとして取り出す必要があり、可溶化されたGPCRの親水性表面はさらに少なくなることに起因する。これらの問題を克服するために、細菌由来の安定な可溶性タンパク質であるT4リゾチームやアポシトクロームb562RIL変異体をGPCRの融合パートナーとしてフレキシブルな細胞内第3ループに挿入または置換する方法が考案された。これによりGPCRの運動性を制限すると同時に親水性領域を拡大し、GPCRの安定化と結晶性を向上させることに成功した。同様の目的でGPCRの立体構造を特異的に認識する抗体が当研究室を中心に広く利用されるようになり成果を上げてきた。
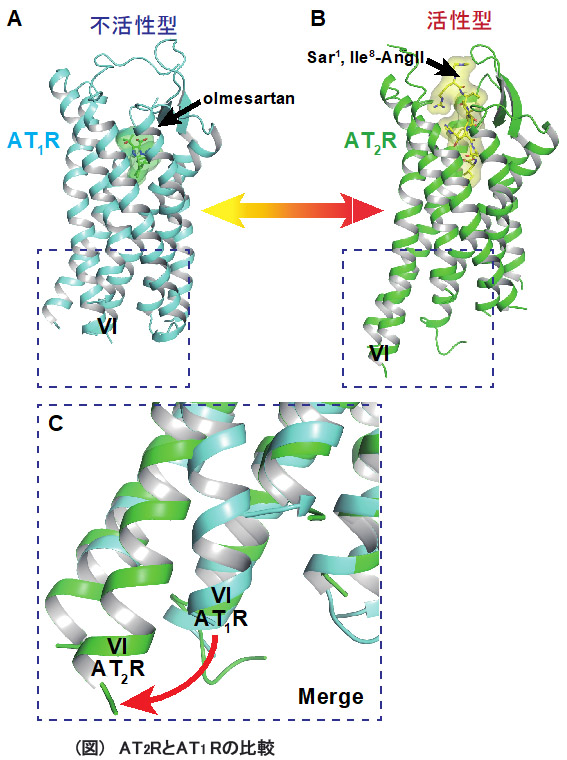
我々は、これらの技術を用いて血圧調節に重要な役割を担うアンジオテンシンII2型受容体(AT2R)および成長ホルモンの分泌促進や食欲増進に重要な役割を担うグレリン受容体(GHSR)などの生理活性ペプチドを受容するGPCRの構造解析を目指している。現在、これらのGPCRに対する特異的抗体の取得、各GPCRと抗体の複合体における結晶化、およびX線回折実験を行っている。特に、AT2Rにおいて、生理活性ペプチドであるアンジオテンシンII類似体である[Sar1, Ile8]-Angiotensin IIが結合した構造を特異的抗体との複合体で決定することに成功した(図)。この構造は、血圧調節時の生理的変化を構造から理解する上で重要な情報であると考えられた。また、このAT2R特異的構造認識抗体は[Sar1, Ile8]-Angiotensin IIの親和性を向上させる機能性抗体であることも確認できた。一方、GHSRについても活性型構造を決定するべく研究を行っている。
-------------------------------------------------------------------------------------------------------------------------------------------------------------
IQGAPファミリーの分子機能の構造生物学的解析
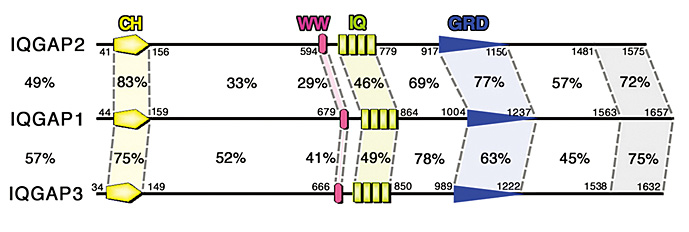
IQGAPファミリー分子は、哺乳類においてIQGAP1,2,3から成る細胞内シグナル伝達分子である(図)。この分子群は共通してそのN末端側から順に
CH、WW、IQ、GRDと呼ばれる機能ドメインを持っており、これらの領域を介して細胞内の他の機能因子と相互作用し、様々な役割を果たしていると考えられている。
また、その機能異常は癌などの疾患との関連も強く疑われている。
IQGAPファミリーの中でIQGAP3は最もその解析が進んでおらず、機能はもちろんその作用機序についてもその多くが明らかにされていない。
私たちは以前の研究において、IQGAP3がIQGAPファミリーの中では唯一、癌原遺伝子産物である低分子量G蛋白質Rasと相互作用し、その活性を正に制御する
(活性化する、もしくは不活性化を阻害する)性質を持っていること、そしてこの性質が特に上皮細胞における細胞増殖に重要な役割を担っていることを明らかにした。
またその後Rasに対する作用はIQGAP3 のGAP様ドメイン(GRD: GAP-related domain)を介して行なわれていることを見出した。
ここで重要な点は、一般的なGAPは低分子量G蛋白質の活性を負に制御するとされていることである。すなわちIQGAP3のGRDは通常のGAPとは全く正反対の活性を持つ
特殊な性質を持っているものと考えられ、その不可思議な作用メカニズムを明らかにする上でその立体構造を理解することは非常に重要であると考えられる。
そこでIQGAP3のGRDの組換え蛋白質を発現精製し、結晶構造解析を行なうことでIQGAP3のRasに対する作用機序を構造レベルで明らかにすることを目的として解析を進めている。
私たちはこのように、細胞生物学的解析から得られた知見をもとに、興味深い分子機能についてそのメカニズムを立体構造レベルで解明することを目指している。
最近の私たちの研究で、さらにIQGAPファミリー分子が上記以外にも新たな興味深い機能を持っていることが明らかになってきた。その中で、
その機能を果たす上でIQGAPが直接結合してその制御を行なっている、エフェクターとなる因子を同定することに成功している。そこで現在、この制御メカニズムを明らかにするため、
両者の複合体の形成・制御機構について細胞生物学・生化学的な解析を行なうとともに、並行して両者の結合領域の組換え蛋白質を各々発現精製し、
それらの複合体の構造解析を進めている。
これらの研究を通じ、IQGAPの多様な分子機能をさまざまな観点から明らかにすることを目指している。
-------------------------------------------------------------------------------------------------------------------------------------------------------------
創薬を目指したGPCRの生化学、薬理学及び構造生物学的な解析
我々のグループは、酵母と昆虫細胞の両方を使ってX線結晶構造解析に適したGPCRの生産を行っています。酵母を利用する利点には、大腸菌なみの取り扱いやすさと培養の容易さ、増殖速度の早さ、
高密度培養があげられます。我々の系の特徴は、二種類の酵母(S. cerevisiae、P. pastoris)を目的に応じて使い分けるところにあります。
S. cerevisiae の細胞内は、相同組換え活性が非常に高く、あらかじめ変異を導入しておいたPCRフラグメントを複数準備するだけで、
複数の変異を一度に導入することができ、効率的な変異体の創出が可能となります。また、GPCRのC末端にGFPを融合させ、蛍光ゲル濾過すること
によりGPCRの安定性や単分散性を簡便に評価することが可能となります(Proc. Natl. Acad. Sci. USA 104: 13936-139341, 2007, Nat. Protoc. 3: 784-798, 2008,Microb. Cell Fact. 11:78, 2012)。
安定化変異体を網羅的にスクリーニングするには最適な系と言えます。P. pastorisは、GPCRの大量生産に使用しています。
P. pastorisはメタノールで制御される強力なプロモーターを有し簡便に安価な培地で高密度培養(菌体量約250g/L培地)が可能です。
我々の研究室でX線結晶構造解析に成功したアデノシンA2a受容体、ヒスタミンH1受容体は、いずれもP. pastorisを使って大量生産しています(Nature 482: 237-240, 2012 , Nature 475: 65-70, 2011)。
このように大量生産したGPCRは、X線結晶構造解析だけでなく、「結晶化リガンド」や「抗体医薬」を目指した機能性抗体取得のための抗原としても利用できます。良い「結晶化リガンド」を作製するには、
まず良い抗原を準備することが重要となります。特に、GPCRのような多数回膜貫通型の膜タンパク質に対して、
立体構造を特異的に認識する抗体を作製するためには、立体構造が正しい(リガンド結合活性を保持した)
GPCRを大量に生産し、高純度精製する必要があります。現在、我々のグループでは、機能性抗体/GPCR複合体として、
アンジオテンシンII受容体、プロスタグランジンE2受容体などの構造解析を試みています。
また、既に我々が構造決定したムスカリンM2受容体(Nature 482: 547-551, 2012)をモデルタンパクとして、新規のアロステリック制御因子を設計し、
受容体との共結晶化を行っています。さらに、シグナル伝達分子(G蛋白質など)との複合体の結晶化にも挑戦しています。
創薬等支援技術基盤プラットフォーム事業
我々は、創薬等支援技術基盤プラットフォーム事業に参加しています。これまでに、X線結晶構造解析に適したヒト膜タンパク質の生産及び結晶化を目指し、 三つのヒトGPCR(アデノシンA2a受容体、ヒスタミンH1受容体、ムスカリンM2受容体)の構造解析に成功しています。このような経験を活かし、 本研究課題では、五つの技術(①発現技術、②精製技術、③結晶化技術、④性状評価支援技術、⑤高難度タンパク質生産技術)を多くのライフサイエンス研究者の方々 に提供しています。また、我々の立ち上げた技術をより使い易く、汎用性の高いものとするために、これまでの技術の「高度化」を目指しています。 解析拠点の一員として、創薬のターゲットとして重要なヒト膜タンパク質の設計、生産、精製、結晶化、構造解析をつなげるパイプラインに参加しています。

図1.出芽酵母を用いた目的遺伝子のクローニングから高発現株スクリーニングまでのフローチャート
出芽酵母は相同組換え活性が高いので,PCRフラグメントと直鎖状にした発現ベクターを混ぜて,出芽酵母にトランスフォーメーションするだけで,簡単にクローニングすることができる.目的タンパク質のC末端にGFPを融合させておくことで,目的タンパク質を精製することなく,簡便に安定性を評価することができる.タンパク質の安定性の評価はSDS-PAGEと蛍光ゲル濾過(Fluorescent Size Exclusion Chromatography; FSEC)で行う.本システムを利用すれば,一週間で50-100変異体の評価が可能になる.
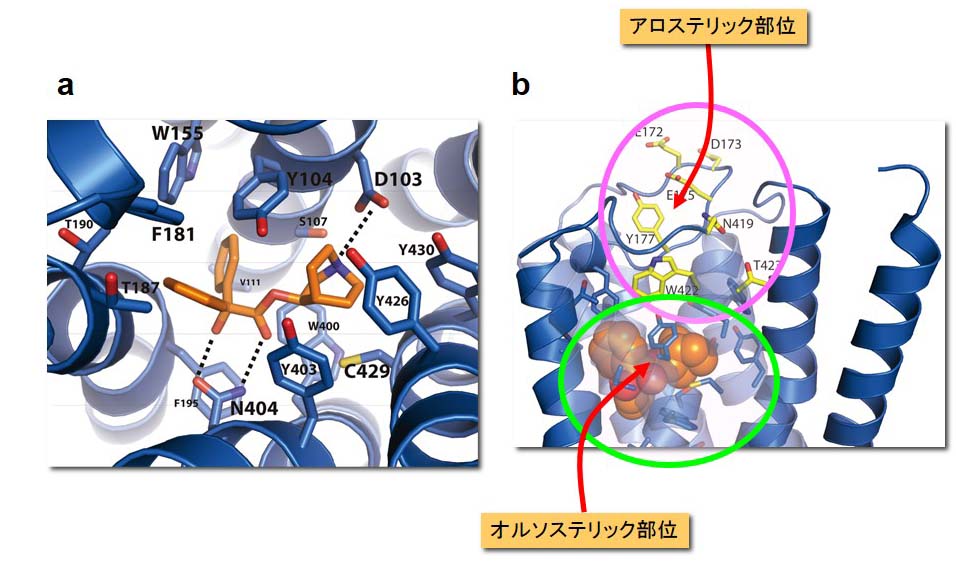
図2.ムスカリンM2受容体のオルソステリック部位とアロステリック部位
a) QNB(オレンジ色)の結合したオルソステリック部位の構造.
b) QNB(オレンジ色)の結合部位の上部にアロステリック部位が存在している.
アロステリック部位とオルソステリック部位を構成するアミノ酸残基をそれぞれ黄色と青色で示す.