クローディンが線維芽細胞にタイトジャンクションを作った!(1999年1月1日の記事)
〜フェイントをかけちゃってご免なさい〜
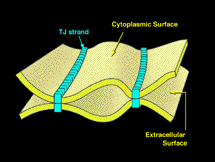 細胞間の物質の漏れを防ぐ分子機構を司るのは、古くから形態学的に知られているタイトジャンクションである。 タイトジャンクションは左図のように、内在性膜蛋白質が膜内で線状に並んだポリマー(ストランド)を形成することにより、このバリアー機能を果たしていると考えられてきた。 このタイトジャンクションのストランドで働く接着分子を見つければ、多細胞生物の形態形成の分子機構を理解する上でも、また、種々の病態を理解する上でも、大きな進歩であることは、古くから認識されてきた。 このような状況下で、我々はオクルディンを1993年の後半に初めて同定することに成功した。 この時の反響は(残念ながら日本国内からの反響は少なかったが、世界からの反響は)すばらしく大きかった。 そして、多くの研究室がオクルディンの解析を始め、オクルディンがタイトジャンクションの機能素子であるとする論文が次々と出された。
細胞間の物質の漏れを防ぐ分子機構を司るのは、古くから形態学的に知られているタイトジャンクションである。 タイトジャンクションは左図のように、内在性膜蛋白質が膜内で線状に並んだポリマー(ストランド)を形成することにより、このバリアー機能を果たしていると考えられてきた。 このタイトジャンクションのストランドで働く接着分子を見つければ、多細胞生物の形態形成の分子機構を理解する上でも、また、種々の病態を理解する上でも、大きな進歩であることは、古くから認識されてきた。 このような状況下で、我々はオクルディンを1993年の後半に初めて同定することに成功した。 この時の反響は(残念ながら日本国内からの反響は少なかったが、世界からの反響は)すばらしく大きかった。 そして、多くの研究室がオクルディンの解析を始め、オクルディンがタイトジャンクションの機能素子であるとする論文が次々と出された。
しかし、我々は釈然としない感触を持っていた。 我々はオクルディンを発見して以来、その機能解析をしようと、いろいろなことを試みたが、他の研究室から出てくるようなクリアーなデータを得ることはできなかった。 何か変だぞと常に思っていた。 我々は、オクルディンのマウスホモログを初めてクローニングに成功した時、すぐに、癌研の野田哲生博士と共同で、オクルディンのノックアウトを試みた。 その結果、最新論文の項にあるように、オクルディンのない上皮細胞でも、立派なタイトジャンクション・ストランドがあることが見出された。 我々としては、本当に焦った。 このノックアウトの結果は、オクルディン以外にタイトジャンクション・ストランドをつくる膜内在性蛋白質が存在することを明瞭に示している。 でも、データベースで検索する限り、オクルディンにいわゆるアイソタイプがあるとは思えない。 では、何がタイトジャンクションを作っているのか?
タイトジャンクションを形成する内在性蛋白質の同定は、これまで最も難しいとされていた分野である。 しかし、今は、オクルディンがある。 オクルディンに結合する蛋白質を探せばよいのではないか。 もちろん、まず、yeast
two-hybridを試みた。 ここで取れるものなら、我々の研究室以外から既に報告があったであろう。 確かに、ネガティブな結果のみ得られた。 RT−PCRを始め、免疫沈降、いろいろやった。 すべてネガティブデータであった。 そこで、最初のジャンクション分画に戻った。 発想は簡単である。 目指す内在性膜蛋白質は、オクルディンと同様にジャンクション分画に濃縮している筈である。 その量も、オクルディンに遜色ない筈である。 我々は、このような発想から、ジャンクション分画をもう一度、徹底的に解析し、分子量22kDの4回膜貫通蛋白質がタイトジャンクションに濃縮することを見出した。
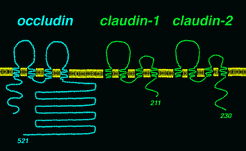 この膜蛋白質をクローディン(claudin)ー1とー2と名付けたが、その後の研究で、クローディンはー8まで見つかっている。 左図にあるように、少なくとも肝臓のタイトジャンクションのストランドは、オクルディンと、クローディンー1、ー2の3種類の4回膜貫通蛋白質から出来ていることになる。
この膜蛋白質をクローディン(claudin)ー1とー2と名付けたが、その後の研究で、クローディンはー8まで見つかっている。 左図にあるように、少なくとも肝臓のタイトジャンクションのストランドは、オクルディンと、クローディンー1、ー2の3種類の4回膜貫通蛋白質から出来ていることになる。
それでは、クローディンとオクルディンはどのようにタイトジャンクションストランドの形成や、タイトジャンクションのバリアー機能、フェンス機能に貢献しているのであろうか? この疑問に答える実験は始まったばかりである。 しかし、最近、この疑問の一部に答えるきわめて興味深い結果を得た。 詳細は、最新の論文の項に紹介しているが、タイトジャンクションを持たないマウスL線維芽細胞にクローディンー1またはクローディンー2のcDNAを導入したところ、なんと、得られたトランスフェクタント間に立派なタイトジャンクションストランドのネットワークができてしまったのである。 この構造を、通常の凍結割断レプリカ法で観察したのが左下図で、本講座の最初のホームページに掲載されていたものである。 このタイトジャンクションネットワークは巨大なもので、光学顕微鏡レベルでも観察できる。 では、オクルディンはどうか? これも詳細は論文を参照されたいが、結論として、オクルディンはクローディンと細胞膜の中で共重合してストランドを作っていることが明らかになった。
 多細胞生物の構築の中で、タイトジャンクションの果たす役割は本質的に重要である。 そのタイトジャンクションの分子構築がほぼ解明された。 細胞生物学を標榜してきた研究室としては、これはかなり誇っても良い成果ではないかと率直に思う。 それも、今の時代には珍しく、ほぼここまで独走してこれたのだから。 なぜこの世知辛い世の中で独走できたのか? これはかなり運が良かったと思う。 だいたい、クローディンという本命が大部分細胞膜の中に埋まっている蛋白質で、今の分子細胞生物学の技術で捕まえ難かったことが、そもそもの強運の始まりである。 モノクローナル抗体法で抗体が誰も取れなかったし、細胞膜内の結合はyeast
two-hybridが苦手としていた。 しかし、今の状況で一番おもしろい強運は、オクルディンが本命でなかったことであろう(オクルディン自体はおもしろく、そのノックアウトマウスの解析も進みつつあるが、タイトジャンクションストランド形成と言う点では本命ではない)。 オクルディンを報告してから、上述したように多くの研究室が飛びついた。 その成果が今頃相次いで報告されている(1998年度で今までに50以上の論文が掲載されているようである)。 オクルディンに関する総説まで2,3書かれている状態にまでなった。 ところが、形としては、今年の前半に、我々自身がオクルディンをノックアウトしてもタイトジャンクションはできるという、ブチコワシ論文を報告し、さらに息つぐ暇もなく2つ(実際には3つになるが)のクローディン論文を発表した(「息つぐ暇がない」ようになったのは、我々としても新しいタイトジャンクション膜蛋白質の手掛かりを得ずして、ブチコワシ論文を書く勇気がなかったことにもよっているので、悪気があった訳ではない)。 結果としては、多くの研究室に、サッカーでいうところのフェイントをかけたような状況が生まれてしまった。 多くのポツドクや学生がオクルディンがタイトジャンクションストランドの中心的蛋白質だという仮定のもとに解析を続けていた筈であるが、今や、クローディンなしにはタイトジャンクションが語れないであろうという奇妙な状況が生まれた訳である。 この人たちには気の毒だが、一時の静寂をできるだけ利用して、リードを広げたいのが本音である。 タイトジャンクションは、一般に思われているよりもかなり本質的な問題を含んでいるので、多くの人が態勢を立て直して追っかけてくることは必至である。 これはオクルディンの時に痛感した。 ウーム、これから何に集中してやっていくか? ノックアウトか? それとも−−−−。 毎日、議論をして唸っている。
多細胞生物の構築の中で、タイトジャンクションの果たす役割は本質的に重要である。 そのタイトジャンクションの分子構築がほぼ解明された。 細胞生物学を標榜してきた研究室としては、これはかなり誇っても良い成果ではないかと率直に思う。 それも、今の時代には珍しく、ほぼここまで独走してこれたのだから。 なぜこの世知辛い世の中で独走できたのか? これはかなり運が良かったと思う。 だいたい、クローディンという本命が大部分細胞膜の中に埋まっている蛋白質で、今の分子細胞生物学の技術で捕まえ難かったことが、そもそもの強運の始まりである。 モノクローナル抗体法で抗体が誰も取れなかったし、細胞膜内の結合はyeast
two-hybridが苦手としていた。 しかし、今の状況で一番おもしろい強運は、オクルディンが本命でなかったことであろう(オクルディン自体はおもしろく、そのノックアウトマウスの解析も進みつつあるが、タイトジャンクションストランド形成と言う点では本命ではない)。 オクルディンを報告してから、上述したように多くの研究室が飛びついた。 その成果が今頃相次いで報告されている(1998年度で今までに50以上の論文が掲載されているようである)。 オクルディンに関する総説まで2,3書かれている状態にまでなった。 ところが、形としては、今年の前半に、我々自身がオクルディンをノックアウトしてもタイトジャンクションはできるという、ブチコワシ論文を報告し、さらに息つぐ暇もなく2つ(実際には3つになるが)のクローディン論文を発表した(「息つぐ暇がない」ようになったのは、我々としても新しいタイトジャンクション膜蛋白質の手掛かりを得ずして、ブチコワシ論文を書く勇気がなかったことにもよっているので、悪気があった訳ではない)。 結果としては、多くの研究室に、サッカーでいうところのフェイントをかけたような状況が生まれてしまった。 多くのポツドクや学生がオクルディンがタイトジャンクションストランドの中心的蛋白質だという仮定のもとに解析を続けていた筈であるが、今や、クローディンなしにはタイトジャンクションが語れないであろうという奇妙な状況が生まれた訳である。 この人たちには気の毒だが、一時の静寂をできるだけ利用して、リードを広げたいのが本音である。 タイトジャンクションは、一般に思われているよりもかなり本質的な問題を含んでいるので、多くの人が態勢を立て直して追っかけてくることは必至である。 これはオクルディンの時に痛感した。 ウーム、これから何に集中してやっていくか? ノックアウトか? それとも−−−−。 毎日、議論をして唸っている。


 細胞間の物質の漏れを防ぐ分子機構を司るのは、古くから形態学的に知られているタイトジャンクションである。 タイトジャンクションは左図のように、内在性膜蛋白質が膜内で線状に並んだポリマー(ストランド)を形成することにより、このバリアー機能を果たしていると考えられてきた。 このタイトジャンクションのストランドで働く接着分子を見つければ、多細胞生物の形態形成の分子機構を理解する上でも、また、種々の病態を理解する上でも、大きな進歩であることは、古くから認識されてきた。 このような状況下で、我々はオクルディンを1993年の後半に初めて同定することに成功した。 この時の反響は(残念ながら日本国内からの反響は少なかったが、世界からの反響は)すばらしく大きかった。 そして、多くの研究室がオクルディンの解析を始め、オクルディンがタイトジャンクションの機能素子であるとする論文が次々と出された。
細胞間の物質の漏れを防ぐ分子機構を司るのは、古くから形態学的に知られているタイトジャンクションである。 タイトジャンクションは左図のように、内在性膜蛋白質が膜内で線状に並んだポリマー(ストランド)を形成することにより、このバリアー機能を果たしていると考えられてきた。 このタイトジャンクションのストランドで働く接着分子を見つければ、多細胞生物の形態形成の分子機構を理解する上でも、また、種々の病態を理解する上でも、大きな進歩であることは、古くから認識されてきた。 このような状況下で、我々はオクルディンを1993年の後半に初めて同定することに成功した。 この時の反響は(残念ながら日本国内からの反響は少なかったが、世界からの反響は)すばらしく大きかった。 そして、多くの研究室がオクルディンの解析を始め、オクルディンがタイトジャンクションの機能素子であるとする論文が次々と出された。

